化学与生产、生活密切相关。下列叙述正确的是
A.我国古代四大发明之一黑火药由硫酸、硝酸和木炭按一定比例混合制成
B.PH计不能用于酸碱中和滴定终点的判断
C.石油的分馏,煤的干馏、气化、液化均是物理变化
D.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
知识点:化学
D
试题分析:A、我国古代四大发明之一黑火药由硫、硝酸和木炭按一定比例混合制成,A错误;B、pPH计能用于酸碱中和滴定终点的判断,B错误;C、煤的干馏、气化、液化均是化学变化,C错误;D、氯化氢和氨气反应生成氯化铵而冒白烟,因此可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气,D正确,答案选D。
下列实验的现象与对应结论均正确的是
选项
操作
现象
结论
A
将碳酸氢钠分解产生的气体通入CaC l2溶液
l2溶液
产生白色沉淀
CO2与CaCl2溶液反应
B
常温下将Al片放入浓硝酸中
无明显现象
Al与浓硝酸不反应
C
将水蒸气通过灼热的铁粉
有黑色晶体生成
铁与水在高温下发生反应
D
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不在有沉淀产生,再滴加0.1mol·L-1CuSO4溶液
先有白色沉淀生成后变为浅色蓝色沉淀
Mg(OH)2的溶度 积(Ksp)比Cu(OH)2小
积(Ksp)比Cu(OH)2小
知识点:化学
C
试题分析:A、氯化钙和CO2不反应,A错误;B、常温下铝在浓硝酸中钝化,钝化是化学变化,B错误;C、铁与水蒸气在高温下反应生成四氧化三铁和氢气,C正确;D、Mg(OH)2的溶度积(Ksp)比Cu(OH)2大,D错误,答案选C。
设NA表示阿伏加德罗常数的值。下列叙述错误的是
A.标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA
B.20gH218O中含有的质子数为10NA
C.12g金刚石中含有的共价键数为2NA
D.标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA
知识点:化学
A

有短周期X、Y、Z、M、W为五种短周期元素。其中X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L-1;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是
A原素Z、W的简单离子的电子层结构不同
B Y的最高价氧化物的水化物能与其简单气态 氢化物反应生成盐且显碱性
氢化物反应生成盐且显碱性
C由X元素形成的单质不一定是原子晶体
D由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
知识点:化学
C
试题分析:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,15÷3=5,且X与Z 可形成XZ2分子,则X、Y、Z分别为C、N、O三种元素;根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,则出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;根据W的质子数是X、Y、Z、M四种元素质子数之和的1/2,推出W的质子数为1/2×(6+7+8+1)=11,所以W为Na元素。A.氧离子和钠离子的电子层结构相同,A正确;B.氨气和硝酸反应生成硝酸铵,铵根水解溶液显酸性,B错误;C.C60不是原子晶体,C正确;D、X、Y、Z、M四种元素可形成化合物 (NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,前二种为离子化合物,而尿素为共价化合物,尿素中不含离子键,D错误;答案选C。
可形成XZ2分子,则X、Y、Z分别为C、N、O三种元素;根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,则出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;根据W的质子数是X、Y、Z、M四种元素质子数之和的1/2,推出W的质子数为1/2×(6+7+8+1)=11,所以W为Na元素。A.氧离子和钠离子的电子层结构相同,A正确;B.氨气和硝酸反应生成硝酸铵,铵根水解溶液显酸性,B错误;C.C60不是原子晶体,C正确;D、X、Y、Z、M四种元素可形成化合物 (NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,前二种为离子化合物,而尿素为共价化合物,尿素中不含离子键,D错误;答案选C。
高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,具有能量密度大、体积小、重量轻、寿命长、无污染等优点,除比亚迪外目前还没有其他厂家宣称其产品可以大规模实用化。电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列说法正确的是
A.充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2
B.0.1molK2FeO4发生反应,转移电子数约为1.806×1024
C.充电时K2FeO4发生氧化反应
D.放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-
知识点:化学
D
试题分析:A.充电时阳极氢氧化铁失去电子,生成高铁酸钾,A错误;B、0.1molK2FeO4发生反应,转移电子0.3mol,个数约为1.806×1023,B错误;C.充电时K2FeO4是氧化产物,C错误;D.放电时高铁酸钾得到电子转化为氢氧化铁,D正确,答案选D。
室温下,下列有关电解质溶液的说法正确的是
A.想蒸馏水中加入Na2O,水的电离程度变小
B.向0.1mol·L-1的醋酸溶液中加水稀释后溶液中 变大
变大
C.向0.1mol·L-1的醋酸溶液中加水稀释后溶液中 不变
不变
D.向0.1mol·L-1的醋酸溶液稀释到原体积的10倍后,溶液的PH=2
知识点:化学
A
试题分析: A.蒸馏水中加入Na2O生成氢氧化钠,水的电离程度变小,A正确;B.向0.1mol·L-1的醋酸溶液中加水稀释后溶液中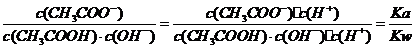 ,温度不变,则比值不变,B不正确;C.无限稀释时,醋酸根离子浓度减小,氢离子浓度基本不变,溶液中
,温度不变,则比值不变,B不正确;C.无限稀释时,醋酸根离子浓度减小,氢离子浓度基本不变,溶液中
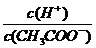 减小,C错误;D.向0.1mol·L-1的醋酸溶液稀释到原体积的10倍后醋酸浓度是0.01mol/L,溶液的pH大于2,D错误,答案选A。
减小,C错误;D.向0.1mol·L-1的醋酸溶液稀释到原体积的10倍后醋酸浓度是0.01mol/L,溶液的pH大于2,D错误,答案选A。
某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加 KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。下列说法正确的是
A.原溶液中肯定不含Fe2+、NO3-、SiO32-、I-
B.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
C.步骤Ⅱ中无色气体是CO2气体
D.原溶液中肯定含有K+、Fe2+、NO3-、SO42-
知识点:化学
D
试题分析:某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰,证明溶液中一定含有K+;Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成,证明含 有NO3-、Fe2+,
有NO3-、Fe2+, 一定不含有SiO32-、CO32-;Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,即为硫酸钡,证明含有SO42-,再滴加KSCN溶液,上层清液变红,即出现了三价铁离子,是Ⅱ过程中亚铁离子被硝酸氧化的结果;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,证明没有碘单质出现,一定没有I-,Cl-是否存在无法确定,A.原溶液中一定含有NO3-、Fe2+,A错误;B.原溶液中含有硫酸根离子,干扰了氯离子的检验,B错误;C.根据分析可知,步骤Ⅱ中无色气体是NO气体,无CO2气体产生,C不正确;D.根据以上分析可知原溶液中肯定含有K+、Fe2+、NO3-、SO42-,D正确,答案选D。
一定不含有SiO32-、CO32-;Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,即为硫酸钡,证明含有SO42-,再滴加KSCN溶液,上层清液变红,即出现了三价铁离子,是Ⅱ过程中亚铁离子被硝酸氧化的结果;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,证明没有碘单质出现,一定没有I-,Cl-是否存在无法确定,A.原溶液中一定含有NO3-、Fe2+,A错误;B.原溶液中含有硫酸根离子,干扰了氯离子的检验,B错误;C.根据分析可知,步骤Ⅱ中无色气体是NO气体,无CO2气体产生,C不正确;D.根据以上分析可知原溶液中肯定含有K+、Fe2+、NO3-、SO42-,D正确,答案选D。
(15分)教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水反应机理
操作
现象
Ⅰ.向盛有4.0gNa202的烧杯中加入50mL蒸馏水
剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a
Ⅱ.向溶液a中滴入两滴酚酞
溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色
Ⅲ.向溶液中加入少量MnO2粉末
又有大量气泡产生,产生的气体也能使带火星木条复燃
(1)Na2O2的电子式为_______,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式_______________________。
(2)操作Ⅱ中红色褪去的可能原因是________________________。
(3)用反应2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O测定溶液a中H2O2含量。取20.00mL溶液a,用稀______(填化学式)酸化,用0.002mol·L-1KMnO4溶液滴定,至终点时平均消耗10.00mLKMnO4溶液。滴定时KMnO4溶液应装在_______(填酸或碱)式滴定管中,终点确定的方法是___________,经计算溶液a中c(H2O2)=__________________________mol·L-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为_____________________________。
(5)向FeSO4溶液中加入一定量Na202固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式______________________________________。
知识点:化学
(1)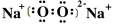 2Na218O2+2H2O═2Na18OH+2NaOH+18O2↑
2Na218O2+2H2O═2Na18OH+2NaOH+18O2↑
(2)溶液a中过量H2O2与酚酞发生反应
(3)H2SO4; 酸; 滴至最后一滴时溶液由紫色变为无色,且半分钟内不变色; 0.0025
(4)4Na2O2+4Fe2+ +6H2O=O2↑+4Fe(OH)3↓+8Na+
(5) 3Na2O2+6 Fe2+ +6H2O=6Na+ +4Fe(OH)3↓+2Fe3+
试题分析:(1)Na2O2是离子化合物,电子式为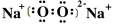 。过氧化钠与水的反应中过氧化钠既是氧化剂,也是还原剂,则Na218O2与H2O反应的化学方程式为2Na218O2+2H2O=2Na18OH+2NaOH+18O2↑。
。过氧化钠与水的反应中过氧化钠既是氧化剂,也是还原剂,则Na218O2与H2O反应的化学方程式为2Na218O2+2H2O=2Na18OH+2NaOH+18O2↑。
(2)过一会与水反应生成双氧水,双氧水具有强氧化性,则操作Ⅱ中红 色褪去的可能原因是溶液a中过量H2O2与酚酞发生反应。
色褪去的可能原因是溶液a中过量H2O2与酚酞发生反应。
(3)高锰酸钾能氧化盐酸,因此应该用稀硫酸酸化;滴定时KMnO4溶液应装在酸式滴定管中,酸性高锰酸钾溶液显紫红色,则终点确定的方法是滴至最后一滴时溶液由紫色变为无色,且半分钟内不变色;反应中消耗高锰酸钾的物质的量是2×10-5mol,根据方程式可知消耗双氧水的物质的量是5×10-5mol,所以溶液a中c(H2O2)=5×10-5mol÷0.02L=0.0025mol·L-1。
(4)过氧化钠溶于水显碱性,且过氧化钠具有强氧化性,能氧化亚铁离子,则向溶液a中滴加FeSO4溶液,发生反应的离子方程式为4Na2O2+4Fe2+ +6H2O=O2↑+4Fe(OH)3↓+8Na+。
(5)向FeSO4溶液中加入一定 量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,反应的离子方程式为3Na2O2+6Fe2+ +6H2O=6Na+ +4Fe(OH)3↓+2Fe3+。
量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,反应的离子方程式为3Na2O2+6Fe2+ +6H2O=6Na+ +4Fe(OH)3↓+2Fe3+。
(14分)氮及其化合物在生产、生活中有着重要的作用。请回答下列问题:
(1)右图是常温下1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_________________________________


(2)在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)⇌2NO2(g)△H如右图
①在0-60s时段,反应速率V(N2O4)为__________mol·L-1·s-1。
②温度升高,混合气体的颜色变深,则△H_____0 (填“>”或“<”)。
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有______(填字母)。
A.向混合气体中通入N2O4 B.升高温度
c.向混合气体中通入NO2  D.使用高效催化剂
D.使用高效催化剂
(3)实验室可用NaOH溶液吸收NO2 ,反应2NO2 +2NaOH=NaN03+NaN02+H2O。含0.2molNaOH的水溶液与0.2molNO2 恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液。
①A、B两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为________________(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1).
②可使A、B两溶液的PH相等的方法是_______(填字母)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(4)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)。0.6molCu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量为_________________。
知识点:化学
(1)NO2(g)+CO(g)=CO2(g)+NO(g);△H=-254kJ·mol-1 (2)①1×10-3; ②>; ③ac
(3)①c(NO3->c(NO2-)>c(CH3COO-);②BC (4)1.8mol
试题分析:(1)根据图像可知反应热△H=134kJ/mol-368kJ/mol=-254kJ/mol,则NO2和CO反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g);△H=-254kJ·mol-1;
(2)①在0-60s时段内N2O4浓度减少了0.1mol/L-0.04mol/L=0.06mol/L,则反应速率V(N2O4)=0.06mol/L÷60s=1×10-3mol·L-1·s-1。
②温度升高,混合气体的颜色变深,这说明NO2浓度增加,即升高温度平衡向生成NO2的分析进行,因此△H>0。
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有______(填字母)。
A.向混合气体中通入N2O4,相当于增大压强,平衡向逆反应方向进行,所以 N2O4的体积分数变大,a正确;B.正反应吸热,升高温度平衡向正反应方向进行,N2O4的体积分数变小,b错误;c.向混合气体中通入NO2,平衡向逆反应方向进行,所以 N2O4的体积分数变大,c正确;D.使用高效催化剂,平衡不移动,平衡向逆反应方向进行,所以 N2O4的体积分数不变,d错误,答案选ac;

(14分)利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH) 的制备流程如下:

已知:FeS2难溶于水,不与H2SO4反应 ,在“还原”步骤中,Fe3+通过反应Ⅰ、Ⅱ被FeS2还原,其中反应Ⅰ为FeS2+14Fe3++8H2O=15Fe2++2SO42- +16H+;反应Ⅱ中氧化产 物为单质硫。
物为单质硫。
(1)“酸溶”中硫酸要适当过量,目的是:①提高铁的浸出率;②____________________。
(2)写出酸溶时硫酸渣中主要成分发生反应的一个化学方程式 :________________________ 。
(3)加入FeS2“还原”时反应Ⅱ的离子方程式为 __________。滤渣的主要成分是FeS2、S和____ (填化学式)
(4)“氧化”时,生成FeOOH的离子方程式为_____________。氧化时,温度不宜过高,否则会导致产品颜色偏红,可能含有的杂质是________________(填化学式)。
(5)滤液中溶质是Al2(SO4)3和____________(填化学式)。
知识点:化学
(1)抑制Fe3+水解 (2)Fe2O3+3H2SO4=Fe(SO4)3+3H2O(3)2Fe3++FeS2=3Fe2++2S;SiO2
(4)4Fe2++8NH3·H2O+O2=4FeOOH↓+8NH4++2H2O;Fe(OH)3 (5) (NH4)2SO4
试题分析:硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有二氧化硅和S、FeS2,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH;
(1)由于铁离子易水解,所以加入稀硫酸的另一个作用是抑制Fe3+水解;
(2)氧化铁是碱性氧化物,可以和硫酸反应生成硫酸铁和水,即Fe2O3+3H2SO4=Fe(SO4)3+3H2O;
(3)FeS2可以将溶液中的Fe3+还原为Fe2+,而本身被氧化为S沉淀,有关的离子方程式为2Fe3++FeS2=3Fe2++2S;由流程分析可知滤渣的主要成分是FeS2、S和SiO2;
(4)在碱性环境下,亚铁离子可以被氧气氧化为生成FeOOH,则“氧化”中,亚铁离子、氧气及氨水反应生成FeOOH、铵根离子和水,其离子方程式为4Fe2++8NH3·H2O+O2=4FeOOH↓+8NH4++2H2O;氧化时,温度不宜过高,否则会导致产品颜色偏红,这说明可能含有的杂质是氢氧化铁。
(5)滤液I中加氨水调节pH,会生成硫酸铵,所以滤液Ⅱ中溶质是Al2(SO4)3和 (NH4)2SO4。
(15分)化合物H(布洛芬)是临床常用的镇痛消炎药,其合成路线如下(部分反应条件和试剂略)

已知:(1)
(2)
请回答下列问题:
(1)化合物H的分子式是___,化合物B的官能团名称是____,第③步的化学反应类型是____.
(2)第②步反应的化学方程式是____.
(3)化合物G的结构简式是_____.
(4)第④步反应的化学方程式是____.
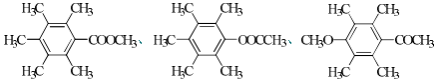
(5)同时满足下列条件的H的所有同分异构体的结构简式是_____.
I.结构中有苯环,无-O-O-;
II.核磁共振氢谱为4组峰,峰面积之比为2:2:1:1.
知识点:化学
(1)C13H18O2; 羧基、氯原子; 取代反应
(2)
 (3)
(3) (4)
(4)

(5)
试题分析:A氧化生成B为ClCH2COOH,B与乙醇发生酯化反应生成C为ClCH2COOC2H5。D与CH3COCl发生取代反应生成E为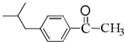 ,E与C发生信息(2)中的反应生成F为
,E与C发生信息(2)中的反应生成F为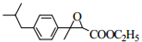 ,对
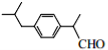
,对 比F、G的分子式及H的结构可知G为
比F、G的分子式及H的结构可知G为 ,G发生氧化反应生成H。
,G发生氧化反应生成H。
(1)化合物H的分子式是:C13H18O2;B为ClCH2COOH,化合物B的官能团为羧基、氯原子,第③步的化学反应类型是取代反应;
(2)第②步反应的化学方程式是:
 ;
;
(3)化合物G的结构简式是:
 ;
;
(4)第④步反应的化学方程式是:
 ;
;
(5)H的同分异构体满足:I.结构中有苯环,无-O-O-;II.核磁共振氢谱为4组峰,峰面积之比为2:2:1:1,符合条件的同分异构体有:
 。
。