下列符合化学实验“绿色化”的有:
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液和废碱液中和后再排放
A ①② B ①③ C ②③ D ①②③
知识点:仪器和基本操作
D
本题考查“绿色化学”知识。据“绿色化学”知识必须控制污染物产生,因为单质碘比单质溴更易溶于CCl4,铜与浓H2SO4反应中,通过调节铜丝的高度,可发生下列反应:2Cu+O2![]() 2CuO, CuO+H2SO4===CuSO4+H2O。酸与碱中和生成中性的盐和水,故①②③均正确。
2CuO, CuO+H2SO4===CuSO4+H2O。酸与碱中和生成中性的盐和水,故①②③均正确。
A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答
(A)实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从下图中选择制取气体的合适装置:
氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用
,灼烧后的坩埚应放在
上,不能直接放在桌面上。
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角 d 表面皿 e 坩埚钳 f 试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a 灼烧过程中部分氧化铜被还原 b 灼烧不充分铜未被完全氧化
c 氧化铜在加热过程中分解生成铜 d 该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次
(6)若测定结果x值偏高,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 胆矾晶体部分风化
知识点:综合性实验
(A)(1)a、b
(2)干燥气体 控制氢气和氮气的流速
(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生
(5)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(6)![]()
![]()
(B)(1)c e b
(2)a b
(3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气的气体
(5)4
(6)a
(A)本题考查氨的合成和氨催化氧化的实验题。制取氮气用氯化铵溶液与亚硝酸钠(NaNO2)溶液加热反应生成,故选a装置,制取氢气用锌与稀H2SO4反应不用加热,选b装置。甲装置的作用混合氮气、氢气,干燥气体,控制氮气和氢气的流速。从氨合成器中出来的气体主要是N2、H2,通入水中吸收氨气,因为N2、H2难溶于水,不会倒吸。氨的催化氧化是一个放热反应,铂丝保持红热,锥形瓶中发生下列反应:4NH3+5O2![]() 4NO+6H2O,2NO+O2===2NO2有红棕色气体产生,3NO2+H2O===2HNO3+NO,HNO3+NH3===NH4NO3。
4NO+6H2O,2NO+O2===2NO2有红棕色气体产生,3NO2+H2O===2HNO3+NO,HNO3+NH3===NH4NO3。
【解析】(B) 本题是一道由Cu制取CuSO4·H2O的实验题。灼烧除去铜中的大量有机物,瓷坩埚具体操作把坩埚放在泥三角上加热,用坩埚钳把坩埚转移到石棉网上冷却。灼烧后,含有少量铜,原因是灼烧不充分或灼烧过程中有部分CuO被还原成Cu,CuO不会分解生成Cu,故a、b正确。途径Ⅰ必须用浓H2SO4产生污染环境的SO2气体,并且消耗H2SO4的量多。测定结晶水中x值至少称量4次,分别是称量坩埚、称量坩埚与晶体、两次称量坩埚与粉末。加热温度过高CuSO4分解,减少的质量增加,测定晶体中水的量增加,x值偏高,b、c、d三个选项中测定晶体中水的量减小,x值偏低。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有![]() 的方法是:
的方法是:
。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
温度(℃)
0
20
60
K2SO4溶解的量(g)
7.4
11.1
18.2
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a 熔点较低(29℃熔化) b 能导电 c 能制冷 d 无毒
(7)上述工艺流程中体现绿色化学理念的是: 。
知识点:物质的分离、除杂和提纯
(1)CaCO3 NH3 H2O
(2)CaSO4+ CO32-→CaCO3↓+ SO42-
(3)CaSO4
(4)滤液中滴加盐酸产生气泡
(5)54g
(6)a d
(7)碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
本题是考查资源综合利用的试题,把化学反应原理应用于工业生产。由题意可知所用的原料CaSO4·2H2O、KCl、NH3、H2O、CaCO3,石膏悬浊液与碳酸铵溶液反应的离子方程式为CaSO4+
CO32-===CaCO3↓+ SO42-,过滤Ⅰ操作中所得固体为难溶CaCO3,还有微溶CaSO4。检验(NH4)2SO4溶液中含有CO32-的方法是加入盐酸,根据是否有气体产生来确定有无CO32-。60 ℃ K2SO4饱和溶液中溶质质量为:591 g×![]() =91 g,溶剂水质量为500 g,500 g水在0 ℃溶解K2SO4的质量为:
=91 g,溶剂水质量为500 g,500 g水在0 ℃溶解K2SO4的质量为:![]() =37 g,析出K2SO4晶体的质量为91 g-37 g=54 g。用氯化钙结晶水合物作为无机储热材料是因为熔点低,无毒。本工艺流程体现绿色化学理论是原子利用率高,没有有害的物质排入到环境中。
=37 g,析出K2SO4晶体的质量为91 g-37 g=54 g。用氯化钙结晶水合物作为无机储热材料是因为熔点低,无毒。本工艺流程体现绿色化学理论是原子利用率高,没有有害的物质排入到环境中。
离子检验的常用方法有三种:
检验方法
沉淀法
显色法
气体法
含义
反应中有沉淀产生或溶解
反应中有颜色变化
反应中有气体产生
下列离子检验的方法不合理的是
A NH4+-气体法 B I--沉淀法
C Fe3+-显色法 D Ca2+-气体法
知识点:物质的检验和鉴别
D
本题考查常见离子的检验方法。已知沉淀法、显色法、气体法的条件;A项中NH4+加碱生成氨气,B项中I-与Ag+生成AgI;C项Fe3+与SCN-生成Fe(SCN)3溶液显红色;D项中Ca2+与CO32-生成CaCO3沉淀,应是沉淀法,故D项错误。
可用下图装置制取(必要时可加热)、净化、收集的气体是
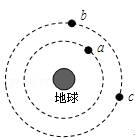
A 铜和稀硝酸制一氧化氮 B 氯化钠与浓硫酸制氯化氢
C 锌和稀硫酸制氢气 D 硫化亚铁与稀硫酸制硫化氢
知识点:仪器和基本操作
D
本题是一道气体的净化和收集的实验题。A选项错误,一氧化氮气体不能用排空气法收集,因为2NO+O2===2NO2。B选项正确,用本实验装置制取气体需要加热,且所得气体的密度比空气的密度大,能用排气法收集,并且能用浓H2SO4干燥。C项氢气密度比空气小,D项硫化氢气体不能用浓H2SO4干燥,C、D都不正确。
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、 等。
(2)若用上图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间
同一反应温度
反应温度/℃
转化率(%)
选择性(%)*
反应时间/h
转化率(%)
选择性(%)*
40
77.8
100
2
80.2
100
60
92.3
100
3
87.8
100
80
92.6
100
4
92.3
100
120
94.5
98.7
6
93.0
100
*选择性100%表示反应生成的产物是乙酸乙酯和水
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为 _____。
知识点:物质的检验和鉴别
(1)增大乙醇的浓度 移去生成物
(2)原料来不及反应就被蒸出 温度过高,发生了副反应 冷凝效果不好,部分产物挥发了(任填两种)
(3)产生大量的酸性废液(或造成环境污染) 部分原料炭化 催化剂重复使用困难 催化效果不理想(任填两种)
(4)①C ②乙醇脱水生成了乙醚
本题为实验探究题,主要考查考生对影响化学反应速率的因素及影响化学平衡因素的掌握程度。(1)由于酯化反应为可逆反应,欲提高乙酸的转化率,应使化学平衡向正反应方向移动,故可采用增大乙醇的浓度或降低乙酸乙酯的浓度(如移去),或移去H2O等措施。(2)乙酸乙酯产率低可从试剂和装置两个方面来考虑,试剂方面可能是反应物来不及反应就被蒸出或反应温度过高发生了副反应;从装置来看则可能是冷凝效果不好,部分产品挥发了等。(3)由于浓H2SO4具有强氧化性和脱水性,故可造成一方面产生酸性废气,同时使部分原料炭化,甚至会产生SO2等大气污染物,当然催化剂的重复使用也较困难,催化效率也不高等都是需要解决的问题。(4)由表中数据可以看出,温度升高转化率越高,但在120 ℃有副反应发生,反应时间越长,转化率越高;但温度高能耗高,时间长单位时间内产量低,综合考虑本题答案为C。
下列实验可行的是
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
D.用乙醇从碘水中萃取碘
知识点:仪器和基本操作
A
本题主要考查考生简单实验的设计能力。CO2、HCl皆与NaOH反应,B不可行;可使蛋白质发生颜色反应的是浓HNO3而不是浓H2SO4,C不可行;选取的萃取剂必须满足两个条件:①与原溶剂不相互溶,②I2在该物质中的溶解度大于I2在水中的溶解度,显然D不可行;由Cu+2Ag+===Cu2++2Ag,A选项正确。
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是

知识点:仪器和基本操作
D
本题主要考查化学实验设计。集气瓶作洗气瓶时应长导管通入气体,短导管排出气体,A不正确;由于HCl的溶解度很大,易发生倒吸,故常见导气管末端连接一个倒扣的小漏斗,B不正确;在蒸馏装置中温度计的水银球应放在蒸馏烧瓶的支管口处,C不正确;NH3虽然易与H2SO4反应且在水中溶解度很大,但导出的NH3并不与水溶液直接接触;而NH3不溶于CCl4,故D装置可防止倒吸,D选项正确。
某兴趣小组设计出图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(固定装置略去)
(1)实验前,活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)题27表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 。理由是______________ 。

(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为 ,实验现象为 ;但此实验的不足之处是 。
知识点:物质的检验和鉴别
(1)检查装置气密性。
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
反应变缓,气体颜色变淡。
(3)丙;耗酸量最少,无污染。
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸;c中有黄绿色气体产生,d中溶液变为黄棕色;没有处理尾气。
本题以绿色化学为载体,考查了思维的全面性和优选能力。
三种方案如下:甲:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O;
乙:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O;
丙:2Cu+O2![]() 2CuO,
2CuO,
CuO+2HNO3===Cu(NO3)2+H2O。
三种方案相比:丙方案消耗酸最少,没有污染性气体产生,体现了环保节能的原则。
(4)中的设计原理为:16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O①;Cl2+2Br-===Br2+2Cl-②。
利用①中产生的Cl2,继续反应②,具体操作:
向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓HCl,c中产生的黄绿色气体进入d,产生单质Br2溶液变黄棕色,但没有尾气处理装置。
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
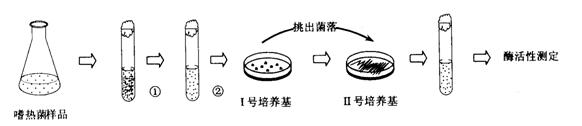
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加人一定量的二氧化锰.通过________________(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有___________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:_______________________________
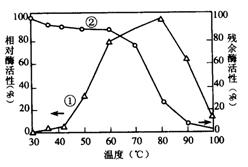
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:_______________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象
原因
溶液最初从紫色逐渐变为____色
氯气与水反应生成的H+使石蕊变色
随后溶液逐渐变为无色
_______________________________________
然后溶液从无色逐渐变为____色
_______________________________________________
知识点:综合性实验
(1)分液漏斗 B
(2)碱溶液(或反应物)的浓度不同,反应温度不同 M 过滤
(3) Cl2 + 2OH-=ClO- + Cl一+H2O
(4)
|
红 |
|
|
|
氯气与水反应生成的HClO将石蕊氧化为无色物质 |
|
黄绿 |
继续通入的氯气溶于水使溶液呈黄绿色 |
本题为实验探究题,主要考查Cl2的制备,Cl2、Cl2-H2O及NaClO等物质的性质,并以此为依托考查考生观察、分析问题的能力。
(1)烧瓶中的MnO2与通过分液漏斗加入的浓盐酸发生反应,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,产生的Cl2中常因浓HCl易挥发而含有HCl,可通过盛有饱和食盐水的洗气瓶除去(浓H2SO4只能干燥Cl2,并不与HCl反应),碱石灰可同时吸收Cl2和HCl,而NaHCO3溶液则会引入新的杂质CO2)。
MnCl2+Cl2↑+2H2O,产生的Cl2中常因浓HCl易挥发而含有HCl,可通过盛有饱和食盐水的洗气瓶除去(浓H2SO4只能干燥Cl2,并不与HCl反应),碱石灰可同时吸收Cl2和HCl,而NaHCO3溶液则会引入新的杂质CO2)。
(2)比较装置②③中所给物质的特点及反应条件可知,制备KClO3和NaClO二者的条件差异在于反应物的浓度不同、反应温度不同;反应完毕后冷却②的试管有大量晶体析出,则该晶体的溶解度随温度升高而增大,故符合曲线M的特征,分离②中的固体与溶液可用过滤的方法。
(4)Cl2+H2O![]() H++Cl-+HClO,生成的H+可使石蕊试液变红色,又由于HClO具有强氧化性,可把石蕊氧化为无色物质,故石蕊试液又变为无色,当然通入的Cl2过量时,水溶液中含较多Cl2而呈黄绿色。
H++Cl-+HClO,生成的H+可使石蕊试液变红色,又由于HClO具有强氧化性,可把石蕊氧化为无色物质,故石蕊试液又变为无色,当然通入的Cl2过量时,水溶液中含较多Cl2而呈黄绿色。