新华社2007年3月21日电,全国科学技术名词审定委员会21日公布:111号元素(符号为Rg)的中文名称为“金仑”(读音为伦)。下列说法正确的是
A.111号元素是第6周期、第ⅠA族的金属元素
B.111号元素属于过渡元素
C.1111号元素为非金属元素
D.111号元素质量数为111
知识点:元素周期律与元素周期表
B
略
科技日报2007年1月30日讯,美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似于由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上。最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如右图。下列有关说法肯定不正确的是
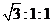
A.Al2H6中H为+1价,Al为—3价
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.Al2H6为非极性分子
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
知识点:镁铝及其化合物
A
略
U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解:
UO2(NO3)2 → UxOy + NO2↑+ O2↑
在600K时,将气体产物收集于试管中并倒扣于水中,气体全部被吸收,水充满试管。则生成的铀的氧化物的化学式是
A.UO2 B.UO3 C.2UO2·UO D.UO2·2UO3
知识点:氧化还原反应
B
略
如图,在注射器中加入少量Na2SO4晶体,并吸入少量硫酸(以不接触纸条为准)。则下列有关说法正确的是
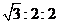
A.蓝色石蕊试低先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色,证明SO2具有漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性强于I2
D.NaOH溶液可用于除去实验中多余的SO2
知识点:氧族元素
D
略
![]() 如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
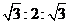
A.增大 B.减小 C.不变 D.无法确定
知识点:化学平衡状态及移动
C
略
超临界流体(Supercritical Fluid)是物质介于气态和液态之间的一种新的状态。超临界二氧化碳可作为溶剂、发泡剂取代某些有机溶剂、氟利昂等。下列有关说法中不正确的是
A.超临界二氧化碳的形成,会引起二氧化碳性质的改变
B.超临界二氧化碳与其气态或液态之间的转化是物理变化
C.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
D.超临界二氧化碳可用物中药、香料中有效成分的提取
知识点:化学与技术
A
略
目前工业生产H2O2的一种新方法的生产过程中,会生成一种中间产物,其结构得式为: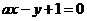 。有关该物质的说法正确的是
。有关该物质的说法正确的是
A.它属于芳香烃 B.它是苯的同系物的含氧衍生物
C.它可能发生消去反应 D.它能与NaOH溶液反应
知识点:苯酚和酚类
D
略
有M、N两种溶液,各含下列10种离子中的5种:Na+、K+、NO3-、OH-、S2-、Fe3+、CO32-、NH4+、SO42-、H+。已知两种溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2- B.SO42-、NO3-
C.OH-、NO3- D.S2-、SO42-
知识点:离子共存
B
略
以惰性电极电解CuSO4溶液,若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出Cu的质量可能为
A.0.64g B.1.28g C.2.56g D.5.12g
知识点:电解池
AB
略
一定温度下,在恒容密闭容器中容器中发生如下反应:2A(g)
+ B(g) ![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为超始物质,平衡后A的体积分数小于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为超始物质,平衡后A的体积分数小于a%的是
A.3molC B.2molA、1molB和1molHe(He不参加反应)
C.1molB和1molC D.2molA、1molB和3molC
知识点:化学平衡状态及移动
A
略
断肠草(Gelsemium)为中国古代必大毒花之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式。下列推断不正确的是
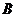
A.①与②;③与④分别互为同分异构体
B.①、③互为同系物
C.①、②、③、④均能与NaOH 溶液反应
D.等物质的量的②、④分别在足量的氧气中完全燃烧,前者消耗氧气比后者多
知识点:有机化学知识综合应用
B
略
最新报道,绿色农药——信息素已推广使用,这对环境保护有重要意义。有一种信息素的结构简式为CH3(CH2)5CH=CH(CH2)9CHO。下列关于检验该信息素中官能团的试剂和顺序正确的是
A.先加酸性高锰酸钾溶液;后加银氨溶液,微热
B.先加溴水;后加酸性高锰酸钾溶液
C.先加银氨溶液,微热;再另取该物质加入溴水
D.先加入新制氢氧化铜悬浊液,微热;再加入溴水
知识点:乙醛和醛类
D
略
CsCl晶体结构如图所示,对相距最近的两个Cs+与它最近的Cl-之间的夹角的判断正确的是
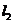 (D)
(D)
A.120° B.90°
C.109°28′ D.以上均不正确
知识点:晶体结构与性质
D
略
Some properties elements belonging to the short periods are listed in the following table.Which of the following statements is true?
Element No.
①
②
③
④
⑤
⑥
⑦
⑧
Atonic radius(10-9m)
0.74
1.52
1.60
1.10
0.99
0.75
1.86
0.82
Highest/lowest valence
-2
+1
+2
+5
-3
+7
-1
+5
-3
+1
+3
A.②号元素和③号元素位于同一周期
B.⑦号元素和⑧号元素位于同一周期
C.④号元素的原子序数大于⑥号元素的原子序数
D.⑤号元素最高价氧化物的水化物的酸性比其他7种元素的相应化合物都强
知识点:元素周期律与元素周期表
CD
略
据2006年12月28日CCTV—1新闻联联播报道,韩国最近研制了新型的大容量燃料电池,能供电脑等用电器连续使用160小时。其工作原理是:甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为:2CH3OH + 3O2 → 2CO2 + 4H2O。下列关于该电池的分析:①H+向负极移动;②负极反应:CH3OH — 6e- + H2O = CO2 + 6H+ ;③1molCH3OH完全反应转移12mol电子;④正极反应:O2 + 4e- + 12H2O = 4OH- 。其中正确的是
A.①⑤ B.①②③④ C.② D.③④
知识点:原电池
C
略
根据量子力学计算,氮化碳结构有五种,其中![]() —氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知氮化碳的二维晶体结构如右图所示,虚线框内表示晶体结构。下列有关氮化碳的说法正确的是
—氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知氮化碳的二维晶体结构如右图所示,虚线框内表示晶体结构。下列有关氮化碳的说法正确的是
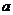
A.β—氮化碳属于分子晶体
B.每个碳原子与四个氮原相连,每个氮原子与三个碳原子相连
C.碳化氮的化学式为C4N3
D.左上角和右下角框内晶胞中均含有四个氮原子和三个碳原子
知识点:晶体结构与性质
BD
略
将0.2molKMnO4在一定温度下加热后生成amolO2;将剩余固体与过量浓盐酸混合加热又生成bmolCl2,此时锰元素均以Mn2+形式存在。若a + b = m,则m的值可能为
A.0.35 B.0.45 C.0.50 D.0.60
知识点:卤素
B
略
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:①反应中除生成NO2气体外还有少量NO生成;②常温下NO2和N2O4混合存在,在低于0℃时,几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计了如图所示的实验装置。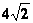
(1)实验开始前要先打开A部分的活塞K1,持续一段通时间的氮气再关闭K1,这样做的目的是_________________________________________________________________。
(2)写出A瓶中Cu与硝酸可能反应的离子方程式______________________________
___________________________________________________________________________。
(3)装置中B瓶的作用是______________________________________。
(4)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是__________________________________________________________。
(5)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是_
_____________________________________________________________________________。
(6)C装置烧瓶中的物质是_______________________,用简单的实验证实你的判断:_____________________________________________________________________________。
(7)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是____________________________________。
(8)若实验只测定Cu的质量分数,不验证NO的产生,则在铜银合金与浓硝酸反应后,只需简单的实验操作就可达到目的,请简述实验过程:___________________________
_____________________________________________________________________________。
知识点:氮族元素
(14分)(1)排尽装置中的空气,防止生成的NO被氧化(1分)
(2)Cu + 2NO3- + 4H+ = Cu2+ + 2NO2↑+ 2H2O(2分)
(3)3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO↑+ 4H2O(2分)
(3)除去气流中的水蒸气(1分)
(4)瓶内出现红棕色(1分)
(5)打开K1、K2,持续通入一段时间的氮气和气(1分)
(6)液态或固态四氧化二氮 在通风柜中取下烧瓶放置,观察到烧瓶中液体(或固体)迅速消失,瓶中充满红棕色气体,证明烧瓶中物质是液态(或固态)N2O4(各1分)
(7)C中圆底烧瓶在实验前后(增加)的质量(2分)
(8)向反应后的混合液中加入过量的NaCl溶液,过滤,洗涤,干燥,称量所得AgCl沉淀质量,再进行计算(2分)(其他合理答案也可)
略
(13分)实验室里用乙醇和浓硫酸反应生成乙烯,接着再用溴与之反应生成1,2—二溴乙烯,在制备过程中有部分乙醇被浓硫酸氧化产生CO2、SO2、SO3进一步与Br2反应生成HBr等物质。

(1)用上列仪器,以上述三种物质为原料制备1,2—二溴乙烷,如果气体流向为从左到右,正确的连接是(短口或橡皮管均已略去):_____经A(1)插入A中,_____接A(2)接______接_____接______接______(填各装置的代号)
(2)在三颈烧瓶A中的主要反应的化学方程式为_______________________________。
(3)在反应管E中进行的主要反应的化学方程式为____________________________。
(4)温度计水银球的正确位置是___________________________________________。
(5)反应管E中加入少量水并把反应管E置于盛有冷水的小烧杯中是因为_________
___________________________________________________________________________。
知识点:烯烃
(13分)(1)B;D;C;F;E;G(6分)
(2)CH3CH2OH![]() C2H4↑+
H2O(2分)
C2H4↑+
H2O(2分)
 (3)CH2=CH2 +
Br2 → BrCH2CH2Br(2分)
(3)CH2=CH2 +
Br2 → BrCH2CH2Br(2分)
(4)应插入液面以下,但不接触瓶底(1分)
(5)溴易挥发,这样做可以减少溴的挥发损失(2分)
略
(14分)右图是元素周期表的另一种画法——塔式周期表,在上面标有部分族及部分元素。请回答下列问题:
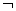
(1)现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。
①在右图塔式周期表相应位置标出A、B、C、D四种元素的元素符号。
②写出上述元素组成的具有漂白作用的四种物质的化学式:_________、___________、____________、_____________。
③C与D形成D的最低价化合物的电子式____________________。
④仅由B、C、D三种元素组成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因______________________________________________________________。
(3)在上述塔式周期表中列出了5行元素,每行所包含的元素种类分别为2、8、8、18、18,可分为三类。第四类元素有两行,其中每行所包含的元素均为________种。请根据行数与元素种类的关系,预言第八行最多可能含有________种元素。
知识点:元素周期律与元素周期表
(14分)(1)见右图(过渡元素涂黑得1分)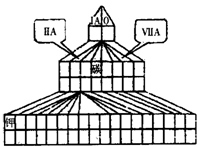
(2)①见右图(四种元素各1分)
②SO2 O2 H2O2 Na2O2(各1分,共4分)
③![]() (1分)
(1分)
④SO32-
+ H2O![]() HSO3-+
OH-或S2O32-
+ H2O
HSO3-+
OH-或S2O32-
+ H2O![]() HS2O3-
+ OH-(2分)
HS2O3-
+ OH-(2分)
(3)32 50 (各1分,共2分)
略
(10分)1911年,Langmuir提出,电子数相同、原子数相同的分子,互称为等电子体。以后又发展成具有相同价电子(最外层电子)数和相同原子数的分子和离子也互称等电子体。X是一种新型无机材料,它与碳化硅(SiC)结构相似,物理性质相近,符合“等电子原理”。X有如下转化关系(图中部分反应的条件及部分生成物中的水已备去)。其中,C是一种能使温润的红色石蕊试纸变蓝的无色气体,D为白色胶状沉淀,E溶液的焰色反应呈黄色,M是一种常见金属,与L反应生成的Q溶液能鉴别酚类物质的存在。试回答问题:
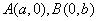
(1)M元素在周期表中的位置__________________。
(2)写出C的空间构型___________________。
(3)X属于_________晶体(填“分子”、“离子”或“离子”)
(4)①写出X与A溶液反应的离子方程式___________________________________。
⑤写出C与G反应的化学方程式________________________________________。
知识点:元素周期律与元素周期表
(10分)(1)第四周期第Ⅷ族(2分)
(2)三角锥型(2分) (3)原子(2分)
(4)①AlN + OH- = AlO2- + NH3↑(2分)
②4NH3
+ 5O2 ![]() 4NO + 6H2O(2分)
4NO + 6H2O(2分)
略
(8分)A、B、C、D分别代表硝酸银、偏铝酸钠、稀盐酸、浓氨水四种无色溶液中的一种。甲、乙两同学分别用两两混合的方法进行了如下图所示的实验,现象有的相同,有的不同,不同部分已标出。
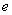
(1)试写出A、B、D、C、D所代表物质的化学式:
A:______________,B______________;C________________;D______________。
(2)写出B和C按物质的量1∶3混合时反应的化学方程式:
______________________________________________________________________。
(3)写出A和D按物质的量之比为3∶1混合时反应的离子方程式:
_______________________________________________________________________。
知识点:无机框图推断
(8分)(1)A为NH3·H2O、B为NaAlO2、C为HCl、D为AgNO3(各一分,共4分)
(2)3NaAlO2 + 9HCl = 2AlCl3 + Al(OH)3↓+ 3NaCl + 3H2O(2分)
(3)Ag+ + 2NH3·H2O = Ag(NH3)2+ + 2H2O(2分)
略
(11分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染,这一材料是由我国某公司最新研发成功的新材料。PETG的结构简式为:
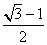
已知:Ⅰ: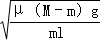
Ⅱ:RCOOR1 + R2OH → RCOOR3 + R1OH
试回答下列问题:
这种材料可采用下列合成路线:
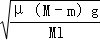
(1)反应②、⑥中加入的试剂X是__________________;
(2)⑤的反应类型是________________;
(3)写出结构简式:B:___________________,I____________________________。
(4)写出化学方程式:
反应③__________________________________________________________________。
反应⑥__________________________________________________________________。
知识点:有机合成及高分子化合物
(11分)(1)NaOH溶液(2分)
(2)取代(1分)
(3)B:CH3—-CH3 I:CH3OOC——COOCH3(各2分,共4分)
(4)HOCH2——CH2OH
+ 3H2 ![]() HOCH2——CH2OH(2分)
HOCH2——CH2OH(2分)
略
(10分)最近报道,在—100℃低温下合成了化合物X,元素分析仪得出其分子式为C5H4,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别没有区别,而碳的化学环境却有两种,温度升高将迅速分解,X的可能结构式是___________、_________、___________;如果分子中有三种环境不同的氢,有四种环境不同的碳,该烃可能的结构式为__________、___________;如果氢有两种环境,碳有四种环境,该烃可能的结构式为_____________、___________;如果氢有两种环境,碳有三种环境,该烃的结构简式可能为____________、______________、_______________。
知识点:有机化学知识综合应用
(10分)
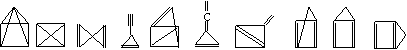
( 每空1分,共10分)(其他合理答案也行)
略
(10分)某化工厂以甲烷为原料合成早醇的反应为:
CH4(g) + H2O(g) → CO(g) + 3H2(g)…………………………①(反应中CH4的转化率:1)
CO(g) + 2H2(g) → CH3OH(g)………………………………②(反应中CO的转化率:2/3)
合成工艺如下(虚线框内为改进后的工艺中新增流程):
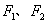
请回答下列问题(所有气体均折算成标准状况):
(1)原工艺中,当充入反应器①的甲烷和水蒸气的体积分别为672m3和1750m3时,最终反应剩余物中n(CO)=___________________,n(H2)___________________。
(2)为充分利用反应剩余物,该厂在原工艺的基础上,将下列反应运用于生产甲烷原料气:2CH4(g) + O2(g) → 2CO(g) + 4H2(g)………………③(反应中CH4的转化率:1)。若新工艺中充入反应器①的甲烷和水蒸气的体积分别为a、3a,反应剩余物中:V(H2)∶V(N2)∶V(CO)=3∶1∶1。试计算:
①充入反应器③的甲烷的体积为_______________。
②若富氧空气中除O2、N2外,其他成分忽略不计,则充入反应器③中的富氧空气的体积为________;应选择氧气的体积分数为_____________的富氧空气。
知识点:乙醇和醇类
(10分)(1)1×104mol 5×104mol(每空1分,共2分)
(2)①2a(4分)
②2a 0.5(50%)(每空2分,共4分)
略