下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
A.常温下,56g Fe与足量的浓硝酸反应,转移的电子数为3 NA
B.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
C.6.4 g铜在硫蒸气中完全燃烧生成硫化亚铜,转移的电子数为0.2NA
D.常温常压下,0.1 mol氖气含有的电子数为NA
知识点:化学
D
【考点】阿伏加德罗常数.
【分析】A.常温下铁与浓硝酸发生钝化现象;
B.稀盐酸不与二氧化锰反应,浓盐酸变成稀盐酸后,反应停止;
C.根据n= 计算出铜的物质的量,反应产物中Cu元素的化合价为+1价;
计算出铜的物质的量,反应产物中Cu元素的化合价为+1价;
D.稀有气体为单原子分子,氖气分子中含有10个电子.
【解答】解:A.常温下Fe与浓硝酸发生钝化,阻止了反应的继续进行,则无法计算转移电子的物质的量及数目,故A错误;
B.二氧化锰足量,稀盐酸不与二氧化锰反应,4mol HCl不会完全反应,则反应生成氯气的物质的量小于1mol,生成氯气在标况下体积小于22.4L,故B错误;
C.6.4gCu的物质的量为: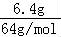 =0.1mol,氯化亚铜中铜元素的化合价为+1,则反应转移电子的物质的量为0.1mol,转移的电子数为0.1NA,故C错误;
=0.1mol,氯化亚铜中铜元素的化合价为+1,则反应转移电子的物质的量为0.1mol,转移的电子数为0.1NA,故C错误;
D.0.1 mol氖气分子中含有1molNe原子,含有电子的物质的量为1mol,含有电子数为NA,故D正确;
故选D.
下列说法正确的是( )
A.依据丁达尔现象可将分散系分为溶液、胶体与浊液
B.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
C.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
D.在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是1:2
知识点:化学
B
【考点】氧化还原反应的计算;化学反应速率的影响因素.
【分析】A.分散系的分离依据为分散质粒子的直径大小;
B.用饱和食盐水替代水,相当于降低了水的浓度;
C.乙酸乙酯在热的NaOH溶液中会发生水解;
D.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,硫元素由0价降低为﹣2价,被还原,所以硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断.
【解答】解:A.分散系的划分是以分散质颗粒大小来区分的,胶体粒子直径介于1nm~100nm之间,溶液溶质粒子直径小于1nm,浊液粒子直径大于100nm,溶液和浊液都不具有丁达尔效应,故A错误;
B.制取乙炔时,用饱和食盐水替代水,相当于降低了水的浓度,可减缓乙炔的产生速率,故B正确;
C.乙酸乙酯在热的NaOH溶液中会发生水解,应用饱和碳酸钠溶液收集产物以除去其中的乙酸,故C错误;
D.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为﹣2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知:作氧化剂的S原子与作还原剂的S原子的物质的量之比为2:1,故D错误;
故选B.
下列各物质中属于纯净物的是( )
①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3•10H2O ⑥氯水 ⑦液氯⑧纯净的盐酸.
A.⑤⑦ B.①⑤⑦⑧ C.①⑤⑥ D.①④
知识点:化学
A
【考点】混合物和纯净物.
【分析】纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分逐项分析即可.
【解答】解:①水玻璃是硅酸钠的水溶液,是混合物;②水泥是硅酸盐材料,是混合物; ③普通玻璃是硅酸盐材料,是混合物;④漂白粉主要成分为次氯酸钙和氯化钙,是混合物;⑤Na2CO3•10H2O是结晶水合物是化合物,是纯净物;⑥氯水是氯气的水溶液是混合物;⑦液氯是单质氯气的液态形式,是纯净物;⑧纯净的盐酸是氯化氢的水溶液是混合物,所以属于纯净物的是 ⑤⑦,故选A.
一定能在下列溶液中大量共存的离子组为( )
A.含有大量Fe2+的溶液:Na+、NH4+、ClO﹣、SO42﹣
B.含有大量氨水的溶液:Ca2+、Mg2+、Ba2+、NO3﹣
C.含有大量AlO2﹣的溶液:Na+、K+、NO3﹣、CO32﹣
D.含有大量NO3﹣的溶液:H+、I﹣、SO42﹣、Cl﹣
知识点:化学
C
【考点】离子共存问题.
【分析】A.离子之间发生氧化还原反应;
B.含有大量氨水的溶液,显碱性;
C.含有大量AlO2﹣的溶液,显碱性;
D.离子之间发生氧化还原反应.
【解答】解:A.Fe2+、ClO﹣发生氧化还原反应,不能大量共存,故A不选;
B.含有大量氨水的溶液,显碱性,不能大量存在Ca2+、Mg2+,故B不选;
C.含有大量AlO2﹣的溶液,显碱性,该组离子之间不反应,可大量共存,故C选;
D.H+、I﹣、NO3﹣发生氧化还原反应,不能大量共存,故D不选;
故选C.
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
A.N2既是氧化剂,又是还原剂
B.NaNO2是氧化剂,氧化产物、还原产物都是N2
C.NH4Cl中的氮元素被还原
D.每生成1 mol N2时,转移电子的物质的量为6 mol
知识点:化学
B
【考点】氧化还原反应.
【分析】由NaNO2+NH4Cl=NaCl+N2↑+2H2O可知,NaNO2中N元素的化合价由+3价降低为0,NH4Cl中N元素的化合价由﹣3价升高为0,以此来解答.
【解答】解:A.该反应中只有N元素的化合价变化,则N2既是氧化产物,又是还原产物,氧化剂与还原剂为反应物,故A错误;
B.NaNO2中N元素的化合价由+3价降低为0,则NaNO2是氧化剂,该反应中只有N元素的化合价变化,则N2既是氧化产物,又是还原产物,故B正确;
C.N元素的化合价升高,则NH4Cl中的氮元素被氧化,故C错误;
D.每生成1mol N2时,由化合价的变化可知,转移电子的物质的量为3mol,故D错误;
故选B.
下列离子方程式正确的是( )
A.金属钠与水反应:Na+2H2O═Na++2OH﹣+H2↑
B.向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH﹣═Al(OH)3↓
C.Fe3O4与稀硝酸溶液反应:2Fe3O4+18H+═6Fe3++H2↑+8H2O
D.NaHSO4溶液与足量Ba(OH)2溶液混合:H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O
知识点:离子方程式
D
【考点】离子方程式的书写.
【分析】A.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒、电荷守恒;
B.氢氧化钠过量,氢氧化铝溶解生成偏铝酸钠;
C.四氧化三铁与稀硝酸反应不会生成氢气;
D.氢氧化钡足量,离子方程式按照硫酸氢钠的化学式组成书写.
【解答】解:A.金属钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH﹣+3H2↑,故A错误;
B.氯化铝与过量氢氧化钠溶液反应生成偏铝酸钠和水,正确的离子方程式为:Al3++4OH﹣=AlO2﹣+2H2O,故B错误;
C.四氧化三铁与稀硝酸发生氧化还原反应生成NO气体,正确的离子方程式为:3Fe3O4+NO3﹣+28H+═9Fe3++14H2O+NO↑,故C错误;
D.NaHSO4溶液与足量Ba(OH)2溶液混合,反应生成硫酸钡、氢氧化钠和水,反应的离子飞方程式为:H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O,故D正确;
故选D.
下列实验操作或说法正确的是( )
A.取4g NaOH加入100mL水中配制浓度为1.0mol/L的NaOH溶液
B.配制一定浓度的溶液时,用蒸馏水润洗容量瓶会使所配制出的溶液浓度偏低
C.除去Fe(OH)3胶体中混有的Cl﹣离子,可用过滤的方法
D.向盛有铜片的试管中加入浓硫酸,加热证明浓硫酸具有强氧化性
知识点:化学
D
【考点】化学实验方案的评价.
【分析】A.加入100mL水中,溶液体积未知;
B.用蒸馏水润洗容量瓶,对实验无影响;
C.胶体、离子均可透过滤纸;
D.Cu与浓硫酸加热反应生成二氧化硫.
【解答】解:A.加入100mL水中,溶液体积未知,不能计算浓度,故A错误;
B.用蒸馏水润洗容量瓶,对实验无影响,则用蒸馏水润洗容量瓶会使所配制出的溶液浓度不变,故B错误;
C.胶体、离子均可透过滤纸,应选渗析法除去Fe(OH)3胶体中混有的Cl﹣离子,故C错误;
D.Cu与浓硫酸加热反应生成二氧化硫,S元素的化合价降低,可证明浓硫酸具有强氧化性,故D正确;
故选D.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
(1)在如图所示仪器中,配制上述溶液肯定不需要的是 (填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 .
(2)在容量瓶的使用方法中,下列操作不正确的是 .
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1﹣2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1﹣2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取的质量为 g.
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好.
(5)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容 ;
②定容时俯视刻度线 .

知识点:化学
(1)AC;烧杯、玻璃棒、500mL容量瓶;
(2)BCD;
(3)2.0;
(4)13.6; 15;
(5)①偏高;
②偏高.
【考点】配制一定物质的量浓度的溶液.
【分析】(1)依据配制一定物质的量浓度溶液的一般步骤选择需要仪器,确定用不到的仪器和缺少的仪器;
(2)依据容量瓶构造及使用方法及注意事项解答;
(3)依据配制溶液体积选择合适的容量瓶,依据m=CVM计算需要溶质的质量;
(4)依据C=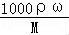 计算浓硫酸的物质的量浓度,依据溶液稀释规律计算需要浓硫酸体积,依据量取浓硫酸体积选择合适的量筒;
计算浓硫酸的物质的量浓度,依据溶液稀释规律计算需要浓硫酸体积,依据量取浓硫酸体积选择合适的量筒;
(5)根据c=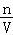 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
【解答】解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量或者量取、溶解或者稀释、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,用不到平底烧瓶和分液漏斗,还缺少的仪器:烧杯、玻璃棒、500mL容量瓶;
故答案为:AC;烧杯、玻璃棒、500mL容量瓶;
(2)A.容量瓶带有瓶塞,使用前应检查是否漏水,故A正确;
B.容量瓶用水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,故C错误;
D.容量瓶为精密仪器,不能用来稀释浓溶液,故D错误;
E.定容后,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故选:BCD;
(3)需要0.1mol/LNaOH溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.1mol/L×40g/mol×0.5L=2.0g,
故答案为:2.0;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C=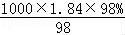 =18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释前后所含溶质的物质的物质的量浓度不变得18.4mol/L×V=0.5L×0.5mol/L,解得V=0.0136L,即13.6mL;需要用15mL量筒量取,
=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释前后所含溶质的物质的物质的量浓度不变得18.4mol/L×V=0.5L×0.5mol/L,解得V=0.0136L,即13.6mL;需要用15mL量筒量取,
故答案为:13.6; 15;
(5)①液体具有热胀冷缩的性质,浓硫酸溶解后未冷至室温即进行定容,冷却至室温时体积变小,溶质不变,溶液浓度偏高,
故答案为:偏高;
②定容时俯视刻度线,导致溶液体积偏小,所以溶液浓度偏高,
故答案为:偏高.
有以下几种物质:①干燥的食盐晶体、②液态氯化氢、③水银、④蔗糖、⑤冰醋酸、⑥KNO3溶液,据此填空(填序号):
(1)以上物质能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3)以上物质中属于非电解质的是 .
知识点:物质的分类
(1)③⑥;
(2)①②⑤;
(2)④.
【考点】电解质溶液的导电性;电解质与非电解质.
【分析】(1)能导电的物质,必须具有能自由移动的带电的微粒,金属能导电是由于金属中存在能自由移动的带负电的电子;
(2)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;
(3)水溶液中和熔融状态下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质,大多数的有机物都是非电解质;
单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质.
【解答】解:(1)能导电的物质,必须具有能自由移动的带电的微粒,金属③水银中存在能自由移动的带负电的电子能导电,⑥KNO3溶液中有能自由移动的正负离子,也能导电,
故答案为:③⑥;
(2)电解质是在水溶液中或熔融状态下能够导电的化合物,满足该条件的有:①氯化钠、②液态氯化氢、⑤冰醋酸,
故答案为:①②⑤;
(2)非电解质是在水溶液中或熔融状态下都不能能够导电的化合物,满足条件的为:④蔗糖,
故答案为:④.
工业上用铝土矿(主要成份是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:

请回答下列问题:
(1)请写主要成份的化学式:滤渣A ,滤液丙中的溶质是NaCl和 .
(2)反应②中Al3+反应的离子方程式为 ;反应③的离子方程式为 ;反应④的化学方程式为 .
知识点:化学
(1)SiO2;NaHCO3;
(2)Al3++4OH﹣═AlO2﹣+2H2O;AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;2Al(OH)3 Al2O3+3H2O.
Al2O3+3H2O.
【考点】工业制金属铝;无机物的推断.
【分析】(1)二氧化硅和盐酸不反应,偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠;
(2)铝离子和过量的氢氧根反应生成偏铝酸盐,偏铝酸盐中通入过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢盐,氢氧化铝受热不稳定,易分解.
【解答】解:(1)铝土矿的成分中,氧化铁和氧化铝均能和盐酸反应得到对应的盐,只有二氧化硅和盐酸不反应,偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠,
故答案为:SiO2;NaHCO3;
(2)氧化铁和氧化铝均能和盐酸反应得到对应的盐,所以滤液甲的成分是氯化铝和氯化铁,铝离子和过量的氢氧根反应为:Al3++4OH﹣═AlO2﹣+2H2O;所以滤液乙的成分是偏铝酸钠,向其中通入过量的二氧化碳,反应为:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;氢氧化铝受热易分解,即2Al(OH)3 Al2O3+3H2O,
Al2O3+3H2O,
故答案为:Al3++4OH﹣═AlO2﹣+2H2O;AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;2Al(OH)3 Al2O3+3H2O.
Al2O3+3H2O.
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂.硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治贫血的药效).
(1)请完成硫酸亚铁在硫酸酸化的条件下与空气中的氧气反应的离子方程式:
Fe2++ O2+ H+═ Fe3++ H2O反应中氧化剂是 (填化学式).
(2)过氧化氢H2O2,(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,也是绿色氧化剂.对于下列A~D的反应,填写空白:
A.H2O2+Ba(OH)2=BaO2+2H2OB.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①H2O2仅体现氧化性的反应是(填代号) .
②H2O2既体现氧化性又体现还原性的反应是(填代号) .
③对于B,标况下生成11.2L的O2,则被还原的物质的质量是 g
④上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: .
(3)除去KCl中的K2CO3,离子方程式是 .
知识点:化学
(1)4;1;4;4;2;O2;
(2)
①D;
②C;
③116;
④Ag2O>H2O2>K2CrO4;
(3)CO32﹣+2H+=CO2↑+H2O.
【考点】氧化还原反应方程式的配平.
【分析】(1)在氧化还原反应中,化合价升高数值=化合价降低数值=转移电子数,根据电子守恒配平化学方程式,化合价降低元素所在的反应物是氧化剂;
(2)①②A.H2O2+Ba(OH)2=BaO2+2H2O中各元素化合价不变,所以不属于氧化还原反应;
B.Ag2O+H2O2═2Ag+O2↑+H2O中Ag元素化合价由+1价变为0价、O元素化合价由﹣1价变为0价,所以氧化银是氧化剂、双氧水是还原剂;
C.2H2O2═2H2O+O2↑中O元素由﹣1价变为0价和﹣2价,所以双氧水是氧化剂和还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中Cr元素化合价由+3价变为+6价、O元素化合价由﹣1价变为﹣2价,所以双氧水是氧化剂,硫酸铬为还原剂,据此分析①②解答;
③根据方程式Ag2O+H2O2=2Ag+O2↑+H2O中氧气计算;
④同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性;
(3)除去KCl溶液和K2CO3的试剂是HCl,碳酸钾和HCl反应生成气体.
【解答】解:(1)铁元素化合价从+2价升高到了+3价,升高了一价,氧气的化合价从0价降低到了﹣2价,生成一分子氧气,降低了4价,所以铁元素的前面乘以系数4,根据电荷守恒,氢离子前边是系数4,水前边系数是2,化合价降低元素是氧元素,所以O2是氧化剂,
故答案为:4;1;4;4;2;O2;
(2)A.H2O2+Ba(OH)2=BaO2+2H2O中各元素化合价不变,所以不属于氧化还原反应;
B.Ag2O+H2O2═2Ag+O2↑+H2O中Ag元素化合价由+1价变为0价、O元素化合价由﹣1价变为0价,所以氧化银是氧化剂、双氧水是还原剂;
C.2H2O2═2H2O+O2↑中O元素由﹣1价变为0价和﹣2价,所以双氧水是氧化剂和还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中Cr元素化合价由+3价变为+6价、O元素化合价由﹣1价变为﹣2价,所以双氧水是氧化剂,硫酸铬为还原剂,
①H2O2仅体现氧化性的反应是D,故答案为:D;
②H2O2既体现氧化性又体现还原性的反应是C,故答案为:C;
③Ag元素化合价由+1价变为0价,化合价降低,故作Ag2O氧化剂被还原,
Ag2O+H2O2=2Ag+O2↑+H2O
232 22.4
m 11.2
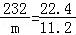 ,m=116,故答案为:116;
,m=116,故答案为:116;
④反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,故氧化性顺序为:Ag2O>H2O2>K2CrO4,故答案为:Ag2O>H2O2>K2CrO4;
(3)除去KCl溶液和K2CO3的试剂是盐酸,碳酸钾和HCl反应生成气体,离子方程式为CO32﹣+2H+=CO2↑+H2O,故答案为:CO32﹣+2H+=CO2↑+H2O.