下列离子方程式书写正确的是
A.少量NaHCO3溶液与过量的Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
B.碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
C.Fe3O4溶于过量的稀HNO3:Fe3O4+8H+=2Fe3++Fe2++4H2O
知识点:离子方程式
A
略
N0代表阿伏加德罗常数的值,下列有关叙述正确的是
A.常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3N0
B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2N0
C.78g Na2O2中所含阴离子的数目是2 N0
D.3.2g S在足量O2中燃烧,转移的电子数为0.6N0
知识点:物质的量的计算
A
略
下列叙述错误的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合液中:
2c(H+) + c(CH3COOH) = c(CH3COO-) +2c(OH-)
B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(s) + I- = AgI(s) + Cl-能够发生
C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.常温下NH4Cl和NH3·H2O的混合溶液中,若pH<7,则c(NH4+)<c(Cl-)
知识点:离子浓度比较
C
略
国际奥委会于2010年2月10日宣布,有30名运动员因为兴奋剂药检呈阳性,从而被取 消参加2010年温哥华冬季奥运会的资格。以下是其中检测出的两种兴奋剂的结构简式:


兴奋剂X 兴奋剂Y
关于它们的说法中正确的是
A.1mol X与足量的NaOH溶液反应,最多消耗3mol NaOH
B.1mol X与足量的氢气反应,最多消耗5mol H2
C.Y能与Na2CO3溶液发生反应放出CO2气体
D.Y遇到FeCl3溶液时发生显色反应,但不能使溴的四氯化碳溶液褪色
知识点:有机化学知识综合应用
B
略
在下列各溶液中,一定能大量共存的离子组是
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO 、Br-、Ba2+
、Br-、Ba2+
C.所含溶质为Na2SO4的溶液 K+ 、CO32-、NO 、Al3+
、Al3+
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
知识点:离子共存
D
略
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC 左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。
 电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池示意如右图,下列说法不正确的是
 A.a极为电池的负极
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应式为:4H+ + O2 + 4e-= 2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
知识点:原电池
D
略
13分)元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g/L,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):

其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式: 。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程
式 ;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式_____________________________________________。
(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是:________________________________________。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式 。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式 ,析出该复盐晶体的原理是______________。
知识点:元素周期律与元素周期表
(13分)
(1) 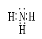 (1分)
(1分)
(2) 3NH3·H2O+Al3+=Al(OH)3↓+3NH4+ Fe+2Fe3+=3Fe2+ (每空2分)
(3) H2O2分子间存在氢键 (2分)
(4)(NH4)2Fe(SO4) 2 (2分)
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2·6H2O (2分)
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多 (2分)
略
(16分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下。


I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
① I中,圆底烧瓶中发生反应的化学方程式是 。
② II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③ III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④ 装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度。取5.5 g 产品,配制成100 mL溶液。取10 mL溶液,以淀粉溶液为指示剂,用浓度为0.050 mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
编 号
1
2
3
4
溶液的体积/mL
10.00
10.00
10.00
10.00
消耗I2标准溶液的体积/mL
19.99
19.98
17.13
20.03
① 判断达到滴定终点的现象是 。
② Na2S2O3•5H2O在产品中的质量分数是(计算结果保留1位小数) 。
(Na2S2O3•5H2O的式量为248)
知识点:综合性实验
(1)①Cu+2H2SO4(浓) CuSO4 + SO2↑+2H2O (2分)
②Na2S2O3在酸性溶液中不能稳定存在 (2分)
打开K2,关闭K1 (2分)
③漏斗、玻璃棒、烧杯 (3分)
④NaOH (1分)
在C中的反应停止后,吸收A中产生的多余SO2 ,防止空气污染 (2分)
(2)①加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变 (2分)
②90.2 % (2分)
略
(14分)汽车尾气净化中的一个反应如下:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g) =CO2(g) △H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
则2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=___________。
N2(g)+2CO2(g)的△H=___________。
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO在t1时刻达
到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol,且N2占平衡总体积
的1/4。
①则该反应的平衡常数K=___________。(用只含a、V的式子表示)
②判断该反应达到平衡的标志是___________
A.v生成(CO2)=v消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变D.NO、CO、N2、CO2的浓度均不再变化
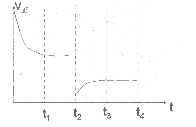
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:

(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是_______
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装
有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。

①写出上述变化中的总化学反应方程式:_____________________________________。
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。请你判断是否可行
并说出理由:_________________________________________________________。
知识点:化学反应速率和化学平衡
.(14分)
(1) △H=-746.5 kJ/mol (2分)
(2)①K=27V/a ②CD ③ (每空2分)
(3)B (2分)
(4)①2NO+O2+4CO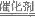 4CO2+N2 (2分)
4CO2+N2 (2分)
②不可行,因为△H>0,△S<0,在任何情况下都不能自发进行。 (2分)
略
(16分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回
收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下:

这种材料可采用常见烃类物质通过如下图所示的路线合成:

(1)已知: 
(2)RCOORl+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1)指出反应类型:⑤ 反应 ⑦ 反应。
(2)写出I的结构简式: ;E物质的核磁共振氢谱有 种。
(3)合成时应控制的单体的物质的量:n(H) ﹕n(E) ﹕n (D)= (用m、n表示)。
(4)写出反应②的化学方程式:
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。
___________________________________________________________________。
知识点:有机化学知识综合应用
(1)加成反应(或还原反应) 取代反应(各1分)
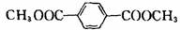 (2)(2分)
(2)(2分)
(3)n:(m+n): m ; 2种(各2分)
(4)BrCH2CH2Br+2H2O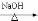 HOCH2CH2OH + 2HBr(2分)
HOCH2CH2OH + 2HBr(2分)
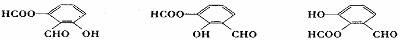 (5) (各2分)
(5) (各2分)
略