下列叙述不正确的是( )
A.铁表面镀一层锌,铁件应连接电源的正极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.金属的电化学腐蚀比化学腐蚀更普遍
D.炒过菜的铁锅未清洗易生锈
知识点:金属的电化学腐蚀与防护
A
略
下列说法正确的是( )
A.热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.根据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
知识点:化学反应与能量的变化
D
略
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
知识点:化学反应速率
C
略
在一个定容密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是( )
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
知识点:化学反应速率和化学平衡的计算
C
略
二氧化硫与氧气的反应为:2SO2(g)+ O2(g) ![]() 2 SO3
(g); △H
<0, 该反应在硫酸工业生产中应采取的适宜条件是( )
2 SO3
(g); △H
<0, 该反应在硫酸工业生产中应采取的适宜条件是( )
A.低温、低压、催化剂 B. 高温、高压、催化剂
C.低温、常压、催化剂 D. 适宜的温度、常压、催化剂
知识点:化学平衡状态及移动
D
略
下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是( )
试管
温度
过氧化氢溶液浓度
催化剂
A
常温
3%
——
B
水浴加热
3%
——
C
水浴加热
6%
MnO2
D
常温
6%
——
知识点:化学反应速率
C
略
在一个密闭的容器中发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g),反应过程中某一时刻SO2 、O2、SO3的浓度均为0.1 mol·L-1,当达到平衡时可能的数据是( )
2SO3(g),反应过程中某一时刻SO2 、O2、SO3的浓度均为0.1 mol·L-1,当达到平衡时可能的数据是( )
A. c(SO3)=0.2 mol·L-1 B. c(SO3)= c(SO2)=0.075 mol·L-1
C. c(SO3)=0.15 mol·L-1 D. c(O2)=0.04 mol·L-1
知识点:化学反应速率和化学平衡的计算
C
略
关于右图装置的说法正确的是( )
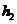
A.银电极是负极
B.铜电极上发生的反应为Cu-2e-=Cu2+
C.外电路中的电子是从银电极流向铜电极。
D.该装置能将电能转化为化学能
知识点:原电池
B
略
用石墨电极电解足量以下溶液,阴、阳两极均产生气体且气体体积之比为2∶1的是( )
A.饱和NaCl溶液 B.Na2SO4溶液 C.CuSO4溶液 D.CuCl2溶液
知识点:电解池
B
略
在密闭的容器中进行如下的反应:H2 (g)+I2(g)![]() 2HI(g),在温度T1和T2时,产物的量与时间的关系如右图所示,符合图象的正确的判断是( )
2HI(g),在温度T1和T2时,产物的量与时间的关系如右图所示,符合图象的正确的判断是( )
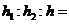
A.T1>T2,△H>0
B.T1>T2,△H<0
C.T1<T2,△H>0
D.T1<T2,△H<0
知识点:化学反应速率和化学平衡
D
略
已知:2Zn(s)+O2(g)=2ZnO(s) ΔH= -701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH= -181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的ΔH为( )
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1 C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
知识点:反应热的计算
C
略
在N2
(g)+ 3H2(g)
![]() 2 NH3 (g)的平衡体系中,其他条件不变,增加氮气的浓度,下列判断正确的是( )
2 NH3 (g)的平衡体系中,其他条件不变,增加氮气的浓度,下列判断正确的是( )
A.氮气的转化率增大 B.氢气的转化率增大
C.氨气在平衡混合气体中的百分含量一定增大
D.氨气的分解速率大于氨气的生成速率
知识点:化学平衡状态及移动
B
略
右图所示为800 ℃ 时,A、B、C三种气体在密闭容器中反应时浓度的变化,从图像上分析不能得出的结论是( )
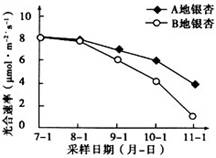
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A (g) ![]() 2 B(g)
+ C(g)
2 B(g)
+ C(g)
知识点:化学反应速率和化学平衡
C
略
某原电池总反应的离子方程式: 2Fe3+ + Fe=3Fe2+,不能实现该反应原理的原电池是
A. 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B. 正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C. 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
D. 正极为Fe, 负极为Zn,电解质溶液为Fe2(SO4)3溶液
知识点:原电池
D
略
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如右图所示。下列判断正确的是
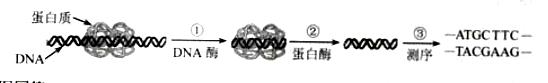
A.在0-50min之间,pH =2和pH = 7 时R的降解百分率相等
B.溶液酸性越强, R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间, pH = 10 时 R 的平均降解速率为 0.04mol·L-1·min-1
知识点:化学反应速率
A
略
一种充电电池放电时的电极反应为:
H2 + 2OH- - 2e-= 2H2O;
NiO(OH) + H2O+e- = Ni(OH)2 + OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A. H2O的还原 B. NiO(OH)的还原 C. H2的氧化 D. Ni(OH) 2的氧化
知识点:氧化还原反应
D
略
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li![]() 的高分子材料。这种锂离子电池的电池反应为: Li+2Li
的高分子材料。这种锂离子电池的电池反应为: Li+2Li![]()
下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e![]() =Li
=Li![]()
B.充电时,Li![]() 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li![]() 向负极移动
向负极移动
知识点:电化学基础
D
略
在体积恒定的密闭容器中,一定量的SO2与1.100mol O2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3(g),ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.达到平衡时,SO2的转化率是90%
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D.降低温度,正反应速率减小程度比逆反应速率减小程度大
知识点:化学平衡状态及移动
B
略
右图装置中发生反应的离子方程式为:Zn+2H+ == Zn2++H2↑,下列说法错误的是( )
A.a、b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
知识点:电化学基础
A
略
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(g)+
2I2(g) ![]() TaI4(g)
+ S2(g)
TaI4(g)
+ S2(g)
下列说法正确的是 ( )

A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
知识点:化学平衡状态及移动
C
略
写出下列反应的热化学方程式。
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2 H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3) 下列各情况,在其中Fe片腐蚀由快到慢的顺序是 (填序号)
知识点:反应热的计算
(1) S(s)+O2(g)= SO2(g)△H= —299.52 kJ·mol-1
(2) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68kJ·mol-1
(3)④②①③
略