下列说法中不正确的是( )
A.IBr分子中,Br为-1价
B.2p3表示2p能级有三个轨道
C.基态18O原子中有8种运动状态完全不同的电子
D.某元素原子的价电子排布为nsn-2npn+1,该元素位于第4周期ⅦA族
知识点:原子结构与性质
B
略
气态中性原子失去一个电子变成气态离子,其原子核外电子排布发生如下变化,吸收能量最多的是( 0.3 )
A. 1s22s22p2→1s22s22p1 B. 1s22s22p4→1s22s22p3
C. 1s22s22p3→1s22s22p2 D. 1s22s22p63s23p2→1s22s22p63s23p1
知识点:原子结构与性质
C
略
四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ; ②1s22s22p63s23p3 ; ③1s22s22p3 ; ④1s22s22p5。下列说法中正确的是( 0.3 )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>①>③=②
知识点:原子结构与性质
A
略
下列有关比较中,不正确的是( )
A.在水中的溶解性:NH3>CH4
B.碳碳键的键长:C2H4>C2H2
C.晶体熔点的高低:SiO2>CO2
D.晶格能的大小:NaF>MgO
知识点:晶体结构与性质
D
略
下表列出了有关晶体的知识,其中完全没有错误的是( )
A
B
C
D
晶体
硫化钾
干冰
金刚石
铝
组成晶体的微粒
K+、S2-
CO2
C
Al3+、e-
晶体熔化时破坏的微粒间作用力
离子键
共价键、范德华力
共价键
金属键
物理性质
熔融时不导电
硬度小,沸点低
硬度大,熔点高
熔融时不导电
知识点:晶体结构与性质
C
略
关于SiO2和CO2的说法正确的是 ( )
A. 碳原子和硅原子都采取sp3杂化
B. CO2分子是直线型结构,SiO2晶体是由共价键形成的空间立体网状结构
C. 干冰是分子晶体,CO2为极性分子
D. 二氧化硅晶体是原子晶体,它的分子式是SiO2
知识点:分子结构与性质
B
略
下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与苯 B.CCl4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
知识点:分子结构与性质
B
略
关于杂化轨道的说法不正确的是( )
A.NH4+中N原子为sp3杂化,空间构型与CH4分子相同
B.BF3中B原子为sp2杂化,故BF3分子为平面三角形
C.BeCl2分子为直线形,所以推知BeCl2分子中Be为sp杂化
D.SO2是极性分子,所以推知SO2分子中S原子为sp3杂化
知识点:分子结构与性质
D
略
向盛有硫酸铜水溶液的试管里加入少量氨水,开始生成浅蓝色的碱式硫酸铜沉淀[Cu2(OH)2SO4],继续加入足量氨水时,沉淀溶解得到深蓝色的铜氨溶液,若在该溶液中加入乙醇,即得到深蓝色晶体[Cu(NH3)4]SO4•H2O。下列说法不正确的是 ( )
A.在[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子
B.生成了深蓝色的[Cu(NH3)4]2+,[Cu(NH3)4]SO4在乙醇中的溶解度较小
C.碱式硫酸铜与氨水反应的离子方程式: Cu2(OH)2SO4 + 8NH3•H2O = 2[Cu(NH3)4]2+ + SO42- + 2OH- + 8H2O
D.深蓝色晶体中只含有离子键、配位键和氢键
知识点:分子结构与性质
D
略
最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的分子式为( ).
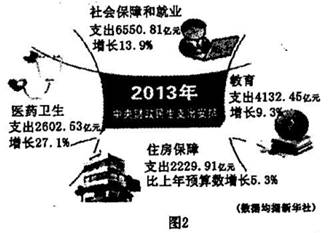
A.Ti14C13 B.Ti13C14 C.Ti4C7 D.TiC
知识点:晶体结构与性质
A
略
X、Y是第三周期主族元素,电负性:X>Y,下列说法错误的是( )
A.Y的气态氢化物的稳定性一定比X的差
B.Y的电离能一定比X的小
C.Y的最高价含氧酸的酸性一定比X的小
D.X与Y若形成化合物,X一定显负价
知识点:原子结构与性质
B
略
最近科学家在实验室里成功地将CO2在高压下转化为类似SiO2的原子晶体。下列关于该CO2晶体的叙述中,不正确的是( )
A.1mol该晶体含4molC-O单键
B.该晶体的熔、沸点高,硬度比SiO2晶体大
C.该晶体中C、O原子最外层都满足8电子稳定结构
D.该晶体中,C和O原子间存在π键
知识点:晶体结构与性质
D
略
R3+的电子排布式为1s22s22p63s23p6,下列有关R的说法错误的是( )
A.R原子的最外层有2个电子
B.R元素在元素周期表中所处的位置为d区,第4周期ⅢB族
C.价层电子排布为4s24p1
D.R原子的3d轨道上有1个未成对电子
知识点:原子结构与性质
C
略
根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体。等电子体之间结构相似、物理性质相近。以下各组粒子不能互称为等电子体的是( )
A. CO和N2 B. O3和SO2 C. N2H4和 C2H4 D.CO2和N2O
知识点:分子结构与性质
C
略
科学家发现的钇钡铜氧化合物在90K具有超导性,若该化合物晶体的晶胞结构如图所示,则该化合物的化学式可能是( )
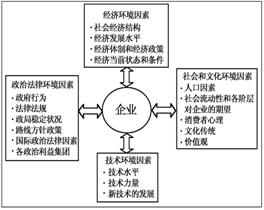
A. YBa2Cu3O3.25 B.YBa2Cu2O5 C.YBa2Cu3O5 D.YBaCu2O3.25
知识点:晶体结构与性质
C
略
(16分)研究物质的微观结构,有助于人们理解物质性质和变化的本质。请回答下列问题。
(1)CH4中H为+1价,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序是:__________________。C60和金刚石都是碳的同素异形体,金刚石的熔点高于C60,原因是:_________________________________________________________。C60被发现后,科学家又合成了结构相似的Si60、N60等,C60、Si60、N60三者的熔点从高到低的顺序是:___________________________。
(2)A、B均为短周期金属元素。依据下表数据和已学知识,写出B原子的电子排布式:____________________________。
电离能/kJ•mol-1
I1
I2
I3
I4
A
932
1821
15390
21771
B
738
1451
7733
10540
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+___________颜色,[Zn(H2O)6]2+___________颜色,(填“无”或“有”)
(4)CO与Cl2在催化剂作用下生成COCl2,COCl2俗称光气,极毒,光气分子呈平面三角形,结构式为![]() ,则其碳原子的杂化类型是_______, COCl2分子内含有________(填标号)
,则其碳原子的杂化类型是_______, COCl2分子内含有________(填标号)
A.4个σ键 B.2个σ键、2个π键
C.3个σ键、1个π键 D.2个σ键、1个π键
知识点:物质的结构与性质

略
(12分)A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;E与F同周期,E的第一电离能高于F;G与F同主族。请回答下列问题:
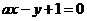
(1)写出G元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素第一电离能由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于分子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,14g B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
知识点:物质的结构与性质

略
19、(24分)氮是地球上极为丰富的元素。填写下列空白。
(1)NH4+中N原子的杂化轨道类型为_____________,NH4+的空间构型为_____________。
(2)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为:__________________,Li3N晶体属于______________晶体(填晶体类型)。
(3)NH3的沸点为234K,NF3的沸点为154K,两者结构相似,NH3的沸点高于NF3的原因是:
_________________________________________________________________。
(4)CO与N2相似,分子中都存在一个共价叁键,CO含_____个π键。下表为CO与N2的相关信息。根据表中数据,说明CO比N2活泼的原因:
化学键
C-O
C=O
C≡O
键能/kJ•mol-1
351
803
1071
化学键
N-N
N=N
N≡N
键能/kJ•mol-1
159
418
946
_________________________________________________________________。
(5)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式。
_____________________________________________________。
化学键
N-N
N=N
N≡N
N-H
H-H
键能/kJ•mol-1
159
418
946
391
436
(6)CO与N2互为等电子体,其碳原子上有一对孤对电子,因此可作配体,如:Fe(CO)5、Ni(CO)4、Cr(CO)6等,在合成氨工业上中用铜洗液吸收CO,反应如下:
[Cu(NH3)2]Ac + CO + NH3 = [Cu(NH3)3CO]Ac
醋酸二氨合铜(I) 醋酸羰基三氨合铜(I)
①基态Fe原子的未成对电子数有________个,写出Cr、Cu+的价层电子排布式。_______________、_______________。
②醋酸二氨合铜(I)和醋酸羰基三氨合铜(I)都是配合物,[Cu(NH3)3CO]+中提供孤对电子的分子是:______________________,接受孤对电子的离子是:______________,用箭号标出[Cu(NH3)2]+形成的配位键:___________________________,[Cu(NH3)2]+中两个配位键的键角为180°,则Cu+采取_________杂化与NH3形成配位键(填杂化类型)。
③Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(7)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定。
①氮化硅晶体属于________________晶体(填晶体类型);
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式:_________________。
(8)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到。2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有________________________。
19、
知识点:物质的结构与性质
(1)sp3;正四面体;
(2)1s22s22p6;离子;
(3)氨分子间存在氢键,使分子间作用力更大;
(4)2; CO中第一个键(π键)的键能比N2的第一个键(π键)的键能小很多,CO的第一个键(π键)容易断裂; (或: C≡O → C=O需268kJ•mol-1 , 而N≡N → N=N需528kJ•mol-1 )
(5)N2(g)+3H2(g)=2NH3(g);△H=-92kJ•mol-1
(6)①4;3d54s1;3d10;②NH3、CO;Cu+;[H3N→Cu←NH3]+;sp;③非极性;
(7)原子; Si3N4;
(8)金属键、共价键。
略