下列说法正确的是
A.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
B.在同一个实验中,同时改变两个变量来研究反应速率的变化,总能更快得出有关规律
C.化学反应中可根据能量变化分为“化合、分解、复分解、置换”四种类型
D.根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体
知识点:化学用语
A
略
下列反应属于加成反应的是
A.(C6Hl0O5)n+nH2O
![]() nC6H12O6
nC6H12O6
淀粉(或纤维素) 葡萄糖
B.CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
C.CH2=CH2+Br2![]() CH2BrCH2Br
CH2BrCH2Br
D.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
知识点:糖类
C
略
室温下10mLpH=3的醋酸溶液作如下改变时,说法正确的是
A.加水稀释到原体积的l0倍,溶液的pH=4
B.加水稀释,溶液中![]() 不变
不变
C.加入10mLpH=11的NaOH溶液,所得混合液的pH=7
D.加入少量醋酸钠固体,则平衡CH3COOH![]() CH3COO—十H+逆向移动,
CH3COO—十H+逆向移动,![]() 变小
变小
知识点:水的电离和溶液的酸碱性
B
略
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是
A.W、M的某些单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,W、Z的氢化物水溶液酸性依次增强
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
知识点:元素周期律与元素周期表
C
略
下列反应的离子方程式正确的是
A.Fe(OH)3悬浊液中加入过量的Hl溶液:Fe(OH)3+3H+===Fe3++3H2O
B.少量醋酸滴入Na2CO3溶液中:2CH3COOH+CO32-===2CH3COO-+CO2![]() +H2O
+H2O
C.Ca(HCO3)2溶液与稀硝酸反应:Ca(HCO3)2+2H+===Ca2++2H2O+2CO2![]()
D.烧碱溶液中加入少量Mg(HCO3)2溶液:
Mg2++2HCO3-+4OH-===Mg(OH)2![]() +2H2O+2CO32-
+2H2O+2CO32-
知识点:离子方程式
D
略
用特殊惰性电极a、b电解稀硫酸产生臭氧,在相同条件下a极产生氢气x升, b极产生氧气和臭氧的混合气y升。则y升混合气中臭氧所占体积分数为(不考虑此条件下臭氧的分解)
A.![]() B.
B.![]()
C. ![]() D.
D.![]()
知识点:电解池
B
略
(14分)下图所示转化关系中(部分生成物未列出),反应①、②是生产C、E两种重要工业产品的主要反应。其中C是由两种元素组成的新型陶瓷,被广泛用于陶瓷工业、电子工业;E是一种有刺激性气味的气体,是生产某些化肥、制造纯碱的原料;A、B、G均为非金属单质,Ⅰ是常见金属单质,其余均为化合物;H是氯碱工业的主要产品之一。

请填写下列空白:
(1)H的化学式为 ; E的电子式为 。
(2)一氧化碳(CO)和F是汽车尾气的部分有害成分,它们在催化剂存在下反应生成两种无毒气体,其反应的化学方程式为 。
(3)工业上利用反应①生产C的化学方程式为 。
(4)将标准状况下224mL的E通入l00mL 0.lmol·L-1的盐酸中,反应后的溶液中离子浓度由大到小的顺序为 。
(5)将G和氧气分别通入多孔的两个铂电极,用一定浓度的H水溶液作为电解质溶液构成氢氧燃料电池,负极的电极反应式为 ,OH-向 极移动(填“正”或“负”)。
知识点:无机框图推断

略
(15分)用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去)。称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解。实验前量气管起始读数为amL,实验后量气管的最终读数为bmL。
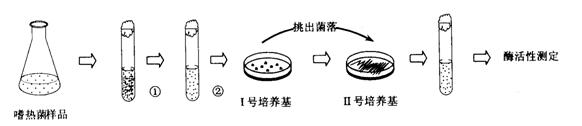
请回答下列问题;
(1)按上图完成装置连接,开始实验前必须进行的操作是 。
(2)写出锥形瓶中发生化合反应的离子方程式: 。
(3)实验结束后,锥形瓶内溶液中存在的金属离子有哪些可能?请根据选项进行填空(表格不一定填完):
A.盐酸 B.KSCN溶液
C.酸性KMnO4溶液 D.H2O2溶液
序号
溶液中可能存在
的金属离子
选择最少种数的试剂,验证该
假设(填字母)
①
②
③
(4)实验中要对量气管多次读数,读数时应注意:①将实验装置恢复到室温;② ; ③视线与凹液面最低处相平。若读取量气管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响’’)。
(5)若样品与足量稀硫酸反应后滴入KSCN溶液不显红色且量气管读数b>a(该实 验条件下的气体摩尔体积为Vm)。下列有关单质铁质量分数的计算过程是否正确 (填“是”或“否”)?理由是 。
Fe+H2SO4===FeSO4+H2![]()
56g VmL
Wg×![]() (Fe)
(b-a)×10-3L
(Fe)
(b-a)×10-3L
……
![]()
知识点:铁及其化合物

略
(14分)在一定温度、一定容积的密闭容器中,发生如下反应:H2(g)+I2(g)![]() 2HI(g)。
2HI(g)。
(1)实验测得:1molH2分子中的化学键断裂时需要吸收436kJ的能量,1mol I2分子中的化学键断裂时需要吸收152.7kJ的能量,1molHI分子中的化学键形成时要释放298.7kJ的能量。则该反应的热化学方程式为 。
(2)在457.6℃时,反应体系中各物质的近似浓度的有关数据如下:

①在上述条件下,从反应开始直至t2时,氢气的平均反应速率为 。
②在上述条件下,对于达到平衡状态的该可逆反应,下列说法正确的是 。
A.达到平衡状态的标志之一是气体的密度不再变化
B.混合气体的颜色不再变化
C.向容器中充入氩气,正、逆反应速率都不变,化学平衡不移动
D.将容器的容积缩小为原来的一半,正、逆反应速率都加快,化学平衡发生移动
③根据表中数据,计算457.6oC时该反应的平衡常数K约为 (保留整数); 若ToC时该反应的平衡常数为0.25,则T 457.6oC(填“=”、“>”或“<”),ToC时将H2和I2各0.1mol的气态混合物充入10L密闭容器中,达到平衡时I2的转化率为 。
(3)25oC时,Ksp(PbI2)=8.49×10-9。将1mL l.0×10-3mol·L-1(CH3COO)2Pb溶液滴入 100mLl.0×10-3mol·L-1的HI溶液中,是否会产生PbI2沉淀? (填“是”或“否”)。
知识点:化学平衡状态及移动
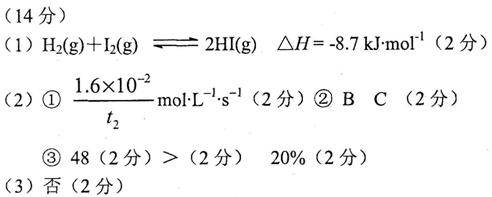
略
[化学—选修2:化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)为除去天然水中含有的一些悬浮物和胶体,可加入的混凝剂是 任写一种物质的名称),请用离子方程式解释其净水作用的原理: 。
(2)离子交换法是用离子交换剂软化水的方法。将RH型阳离子交换树脂和ROH型阴离子交换树脂串接以软化天然硬水,应先使硬水通过 (填“RH”或“ROH”)型离子交换树脂,原因是 。
(3)污水处理的技术很多,可分为物理法、生物法、化学法等。ClO2不仅是一种性能优良的饮用水消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的离子除去。写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式: 。
(4)随着淡水资源的日益匮乏,人们将目光转向了海水。如图所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
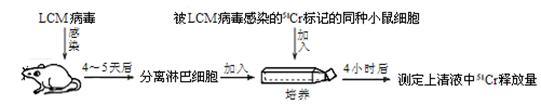
①图中膜a应选择 (填“阳离子交换膜”或“阴离子交换膜”)。
②图中步骤I中已获得Br2,步骤Ⅲ中又将Br2还原为Br-,其目的是 ,若海水中溴含量为0.07mg·cm-3,则年产21000 t液溴需要处理海水的体积为 m3.
知识点:化学与技术

略
[化学—选修3:物质结构与性质](15分)
A、B、C、D、E、F六种元素的原子序数依次增大。F元素的原子序数为29,其余元素均为主族元素。A是元素周期表中电负性最大的元素,B原子半径是同周期中最大的(除稀有气体外),C原子的次外层电子数是最外层电子数的4倍,D、E原子的p轨道中均只有l个未成对电子。
(1)基态F原子的价电子排布式是 。
(2)B、C、D三种元素第一电离能从大到小的顺序是 (填元素符号)。
(3)写出与A的气态氢化物互为等电子体的一种微粒的化学式: 。
(4)含D元素的一种重要化合物LiDH4,可将有机物中的羧基还原为羟基。
例如:CH3COOH![]() CH3CH2OH。
CH3CH2OH。
①在LiDH4中DH4-的立体构型为 。
②在CH3COOH分子中碳原子轨道的杂化类型是
,![]() 键和
键和![]() 键的数
目之比为 。
键的数
目之比为 。
(5)C的氧化物W的晶胞结构与BE相似。在W中C离子的配位数是 ,若W的密度是ag·cm-3,则W晶胞的边长为 cm(只要求列算式不必计算出数值,阿伏加德罗常数为NA)。
知识点:晶体结构与性质

略
[化学—选修5:有机化学基础](15分)
有机化合物A、B、C、D完全燃烧均只生成CO2和H2O,且四种分子中碳的质量分数均为![]() ,氢的质量分数均为
,氢的质量分数均为![]() 。又知:
。又知:
①A常温、常压下呈气态,A、C都能发生银镜反应,但都不能发生水解反应;
②B和C互为同分异构体,l mol B完全燃烧需耗3mol氧气。核磁共振氢谱表明,B分子有四个吸收峰,且峰面积之比为3:1:1:1,B在浓硫酸存在下加热可生成W(C6H8O4,含六原子环);
③RCOOH在一定条件下可被还原为RCHO,以下是由B制取C的一种合成路线(反应条件及副产物已略去):
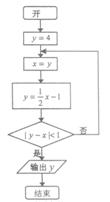
试回答:
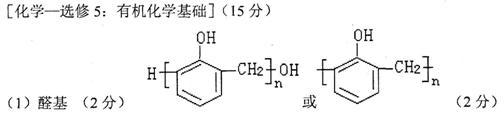
(1)A含有的官能团名称为 ,它与苯酚在酸催化下,可生成一种高分子化合物,该高分二子化合物的结构简式为 。
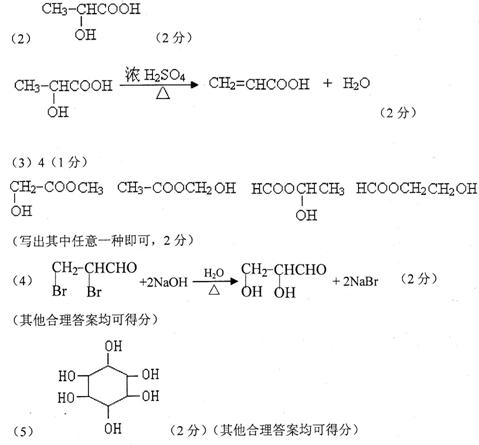
(2)B的结构简式为 。反应B→X的化学方程式为 。
(3)与B互为同分异构体,属于有机酸的酯类且含有羟基的化合物有 种,写出其中一种的结构简式: 。
(4)写出Z→C的化学反应方程式: 。
(5)若MD=6MA,D是只含有一种官能团的六原子环状物,又名肌醇。医学上将肌醇用于动脉硬化、高血脂症、脂肪肝的防治。则D的结构简式为 。
知识点:有机化学知识综合应用
略