化学用语是学习化学的工具和基础。下列有关化学用语的说法或使用正确的是
A.稀有气体的晶体,其组成微粒是原子,晶体中不存在分子间作用力
B.核素C—12的原子组成符号为![]() C,二氧化碳分子的结构式为O=C=O
C,二氧化碳分子的结构式为O=C=O
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D.表示氢气燃烧热的热化学方程式为: 2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol
知识点:化学用语
C
略
下表涉及的四个离子方程式的书写正误判断及改进方法均正确的是
选项
化学反应
离子方程式
判断及改正方法
A
向NH4HCO3溶液中加入少量热的NaOH溶液
OH-+NH4+=NH3·H2O
错误,应将NH3·H2O写成
NH3↑+H2O
B
向Ba(OH)2溶液中滴加H2SO4溶液
Ba2++OH-+H++SO42-=
BaSO4↓+H2O
错误,OH-,H+,H2O的计量系数应均为2
C
向碳酸镁中加入稀硫酸
CO32-+2H+=CO2↑+H2O
没有错误
D
将FeI2滴加到氯水中开始时的反应
2I-+Cl2=2Cl-+I2
没有错误
知识点:离子方程式
B
略
用NA表示阿伏加德罗常数,下列说法正确的是
①18g D2O含有电子数为10 NA; ②1 mol Na2O2与水完全反应时转移电子数为2NA ;③1 mol C10H22分子中共价键总数为31NA; ④在标准状况下,22.4 LSO3的物质的量为1 mol;⑤7.8 g过氧化钠中含有的离子数为0.3NA; ⑥28 g 硅晶体中含有2 NA个Si—Si键 ;
⑦ 200 mL,1 mol / LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA;
⑧在常温常压下,0.1 mol铁与0.1 mol Cl2充分反应,转移的电子数为0.3 NA;
⑨标准状况下,22.4 L NO和11.2 LO2混合后气体的分子总数为1.5 NA;
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2 NA
A.③⑤⑥⑩ B.①③⑤⑧ C.②④⑥⑦ D.③④⑤⑨
知识点:化学中常用计量
A
略
T °C时,在2 L密闭容器中,X、Y、Z三种气体的物质的量随时间变化如下图I所示。若起始时加入一定量的Y,在不同温度下改变X的量时Z的体积分数变化情况如图II所示。则下列结论正确的是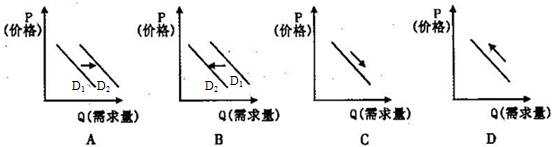
A.该反应的化学方程式为:
2X(g) + Y(g) ![]() 2Z(g)
2Z(g)
B.反应进行的前3min内,用X表示的平均反应速率v(x)=0.067mol/(L·min)
C.由图II可知,其他条件不变,增大X的量时Y的转化率先增大后减小
D.其他条件不变,升髙温度,平衡逆向移动
知识点:化学平衡状态及移动
D
略
瘦肉精(Clenbuterol)是一种非常廉价的药品,但它有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病。瘦肉精是白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚。其结构如图所示,对于瘦肉精的说法正确的是: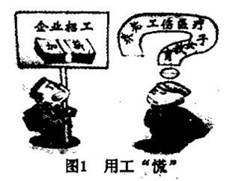
A.瘦肉精的化学式:C12H16N2Cl2O
B.瘦肉精是属于含有肽键的化合物,能与丙氨酸
发生缩聚反应
C.能用乙醚等有机溶剂将瘦肉精从水溶液中萃取出来
D.瘦肉精属于芳香化合物,一定条件下能发生取代、加成、水解等反应
知识点:有机化学知识综合应用
D
略
常温下的4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①NH4Cl与NaOH;②NH4Cl与HCl;③NH4Cl与NaCl;④NH4Cl与NaHCO3,下列各项正确的是
A.pH大小顺序:①>④>③>②
B.c(NH3·H2O)大小顺序:②>④>③>①
C.混合液④中存在: c (NH3·H2O) + c (CO32—) + c (H+) = c (OH—) + c (H2CO3)
D.混合液③中水的电离被促进,其中的c(H+)和c(OH-)均大于1.0×10—7mol/L
知识点:离子浓度比较
A
略
将Na2O2、HCl和Al2O3一起溶于一定量的水中,完全反应后,测得所得溶液中只含有Na+、AlO2-、Cl- (不考虑AlO2-的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能是
A.2∶2∶1 B.3∶3∶1 C.3∶4∶1 D.4∶6∶1
知识点:物质的量的计算
B
略
下图涉及多种无机化工反应,所涉及物质都是由短周期元素组成,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化肥材料,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2:1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
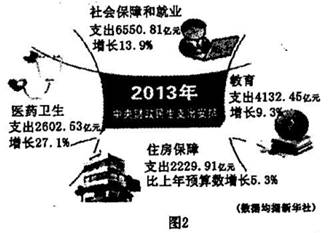
请回答下列问题:
(1)写出B化学式 ,F化学式: ;G的空间构型 。
(2)反应①的化学方程式为
(3)反应④的离子方程式为
(4)上述反应中属于非氧化还原反应的有 (填写相应反应的序号)
(5)Y溶液呈 性(填酸、碱或中),用离子方程式解释
知识点:无机框图推断
(1)Al2O3 CO(NH2)2 三角锥形
(2)N2+Al2O3+3C![]() 3CO+2AlN
3CO+2AlN
(3)AlN+OH—+H2O=AlO2—+NH3↑ (4)④⑦
(5)碱 AlO2—+2H2O![]() Al(OH)3+OH—
Al(OH)3+OH—
略
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2 g。以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
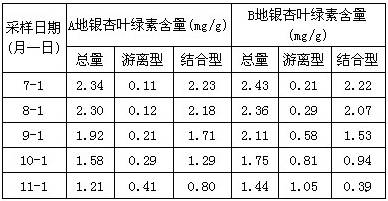
(1)仪器F的作用是______ _____。
(2)已知仪器C中装有品红溶液,其作用是__ ____,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是_____ ____。
(3)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙,请将下列容器中应盛放的试剂序号填入相应空格:B中_______,D中________,E中_______。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是使A、B、C、D各仪器中残留的CO2进入E被充分吸收。所通空气应先经过______试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”,“偏低”或“没影响”)。
(4)若仪器E在试验完成时增重4.4 g,则Na2CO3与Na2SO3的物质的量之比为_______,其中4.4g数值获得的方法是_________ _______。
知识点:综合性实验
(1)防止空气中的水蒸气及二氧化碳气体进入E装置
(2)检验SO2是否除尽;CO2可溶于水
(3)c;a;f;d或f;偏低
(4)1∶1,实验前后称量盛有干燥剂的E质量,求出质量差即可
略
A为芳香烃衍生物,只含C、H、O三种元素,苯环上有两个处于邻位的取代基。
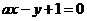
(1)B分子中含氧官能团的名称是 。
(2)写出符合上述条件的A的两种可能的结构简式: ; 。
(3)等量的B分别与Na,NaOH,Na2CO3反应时,消耗三者物质的量之比是 。
(4)符合上述条件的A,其中一种还可发生如下变化:![]()
①A→F的反应类型为 。
②写出有关反应的化学方程式:
此A与新制Cu(OH)2悬浊液的反应:
;
此A对应的B生成C的反应: 。![]()
知识点:有机化学知识综合应用
(1)羟基 羧基
(2)![]()
![]()
(3)4:2:1 (4)消去反应
![]()
略
某盐卤矿抽出的废液中含有大量的K+、Cl—、Br—,及少量的Ca2+、Mg2+、SO42—。某研究性学习小组拟取该废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
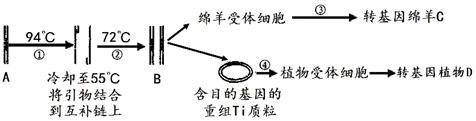
现有可供选择的a、b试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。请根据以上流程,回答相关问题:
(1)试剂a应选_____,该反应在酸性环境中完成,其离子方程式为 。
(2)操作①、②、③、④、⑤的名称依次为______(选填字母)。
A.萃取、过滤、分液、过滤、蒸发结晶 B.萃取、分液、分液、过滤、蒸发结晶
C.分液、萃取、过滤、过滤、蒸发结晶 D.萃取、分液、蒸馏、过滤、蒸发结晶
(3)操作⑤中用到的瓷质仪器名称是 。
(4)选出除去无色液体I中Ca2+、Mg2+、SO42-离子所需的试剂,按滴加顺序依次为
(填化学式)。
(5)调节pH的作用是 ,有关反应的离子方程式是 。
知识点:化学与技术
(1)H2O2 H2O2+2Br- +2H+ =2H2O+ Br2
(2)D (3)蒸发皿
(4)BaCl2、KOH、K2CO3(只要K2CO3在BaCl2之后即可)
(5)除去溶液中过量的OH—、CO32—
OH— + H+ = H2O、 CO32— + 2H+ = H2O + CO2↑
略