当前,食品保质期”失真”问题,正成为食品安全最突出的隐患之一。特别是2011年中秋节前后,湖南浏阳市某食品厂用”药水”涂改生产日期一案更是引起了人们的广泛关注。目前,一种新型化学食品标签——时间—温度指示器(TimeTemperature Indicators,简称TTIs)正悄然进入食品包装之中。这种标签通过运用化学原理及方法对食品的储存时间和温度做出显示,供商家和消费者参考选择,解决了消费者对食品新鲜度的疑问。下列说法错误的是 ( )
A.这种标签是根据温度和时间影响化学反应速率的因素来设计的
B.食品变质腐烂的本质就是食品发生了化学反应
C.该标签不能长期保存,只能随包装袋使用量而同时生产
D.TTIs内物质之间的反应必有颜色或状态的变化(或外加指示剂)用来指示食品是否变质
知识点:化学反应速率
C
略
(2012安徽师大附中高三摸底考试)反应![]()
![]()
![]()
![]() H=+57
H=+57 ![]() 在温度为
在温度为![]() 、T
、T![]() 时,平衡体系中
时,平衡体系中![]() 的体积分数随压强变化曲线如图所示。下列说法正确的是( )
的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
知识点:化学反应速率和化学平衡
C
略
可逆反应![]()
![]()
![]() 在密闭容器中反应,达到平衡状态的标志是( )
在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol ![]() 的同时生成2n mol
的同时生成2n mol ![]() ②单位时间内生成n mol
②单位时间内生成n mol ![]() 的同时生成2n mol NO ③用
的同时生成2n mol NO ③用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态
的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
知识点:化学平衡状态及移动
A
略
已知反应![]()
![]() 2HI(g)
2HI(g)
![]() H<0。有相同容积的定容密闭容器甲和乙,甲中加入
H<0。有相同容积的定容密闭容器甲和乙,甲中加入![]() 和
和![]() 各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。下列说法错误的是( )
各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。下列说法错误的是( )
A.反应放出的热量一定相同 B.此时体系的压强一定相同
C.反应物的转化率可能相同 D.此时HI的浓度一定相同
知识点:化学平衡状态及移动
A
略
在一定条件下,固定容积的密闭容器中反应:![]()
![]()
![]()
![]() H>0
达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
H>0
达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )

A.X表示温度时,Y表示![]() 的物质的量 B.X表示压强时,Y表示
的物质的量 B.X表示压强时,Y表示![]() 的百分含量
的百分含量
C.X表示反应时间,Y表示混合气体的密度 D.X表示![]() 物质的量,Y表示
物质的量,Y表示![]() 的物质的量
的物质的量
知识点:化学平衡状态及移动
B
略
高温下,某反应达到平衡,平衡常数K![]() 恒容时,温度升高
恒容时,温度升高![]() 浓度减小。下列说法正确的是 ( )
浓度减小。下列说法正确的是 ( )
A.该反应化学方程式为![]()
![]()
![]()
B.恒温恒容下,增大压强![]() 浓度一定减小
浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的焓变为正值
知识点:化学平衡状态及移动
D
略
为了研究温度对苯催化加氢的影响,以检验新型镍催化剂的性能。采用相同的微型反应装置,压强为0.78 MPa,氢气、苯的物质的量之比为6.5∶1。定时取样分离出氢气后,分析成分得如下表结果:

下列说法错误的是( )
A.当温度超过280 ℃时,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
B.在110 240 ℃时苯的转化率为100%。说明该镍催化剂活性较高,能够在较宽的温度范围内催化而且不发生副反应
C.增大压强与提高氢气、苯的物质的量之比都有利于提高苯的转化率
D.由表中数据来看,随着反应温度的升高,苯的转化率先升高后降低
知识点:化学平衡状态及移动
A
略
![]() 与KSCN(aq)混合时存在下列平衡:
与KSCN(aq)混合时存在下列平衡:![]()
![]()
![]()
![]() (aq)。已知平衡时,c
(aq)。已知平衡时,c![]() 与温度T的关系如图所示,则下列说法正确的是( )
与温度T的关系如图所示,则下列说法正确的是( )
A.![]() 与KSCN(aq)反应的热化学反应方程式为:
与KSCN(aq)反应的热化学反应方程式为:![]()
![]()
![]()
![]() (aq)
(aq)
![]() H>0
H>0
B.温度为![]() 、T
、T![]() 时,反应的平衡常数分别为
时,反应的平衡常数分别为![]() 、
、![]() 则
则![]()
![]()
C.反应处于D点时,一定有v正>v逆
D.A点与B点相比,A点的c![]() 大
大
知识点:溶解平衡
C
略
在密闭容器中,反应A(g)+2B(g) ![]() C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 ![]() ,c(B)=0.200
,c(B)=0.200 ![]() c(C)=0。反应物A的浓度随时间的变化如下图所示。下列说法正确的是(
)
c(C)=0。反应物A的浓度随时间的变化如下图所示。下列说法正确的是(
)

A.若反应①、②的平衡常数分别为![]() 、
、![]() 则
则![]()
![]()
B.反应A(g)+2B(g) ![]() C(g)的
C(g)的![]() H>0
H>0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 ![]()
知识点:化学平衡状态及移动
B
略
某温度下,反应
![]()
![]()
![]() 的平衡常数为400。此温度下,在容积一定的密闭容器中加入
的平衡常数为400。此温度下,在容积一定的密闭容器中加入![]() 反应到某时刻测得各组分的浓度如下:
反应到某时刻测得各组分的浓度如下:
物质
![]()
![]()
![]()
浓度/
![]()
0.44
0.6
0.6
下列说法正确的是( )
A.![]() 的起始浓度为1.04
的起始浓度为1.04 ![]()
B.此时逆反应速率大于正反应速率
C.平衡时![]() 的浓度为0.04
的浓度为0.04 ![]()
D.平衡时![]() 的转化率小于80%
的转化率小于80%
知识点:化学平衡状态及移动
C
略
已知反应:![]()
![]()
![]()

(1)写出反应的平衡常数表达式K= ;
(2)上图表示反应过程中有关物质的能量,则反应的![]() H 0(填”>““<“或”=“);(Ⅰ)、(Ⅱ)两条曲线中,使用催化剂的是曲线 ;
H 0(填”>““<“或”=“);(Ⅰ)、(Ⅱ)两条曲线中,使用催化剂的是曲线 ;
(3)反应中发生反应的![]() 与被氧化的
与被氧化的![]() 的物质的量比为 ;
的物质的量比为 ;
(4)反应的速率可以用![]() 与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,记录的数据如下:
与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,记录的数据如下:
实验编号
①
②
③
④
⑤
c![]() /
/ ![]()
0.040
0.080
0.080
0.160
0.160
c![]() /
/ ![]()
0.040
0.040
0.080
0.080
0.040
t/s
88
44
22
11
t![]()
则:该实验的目的是
,显色时间t![]()
s,分析表中数据,得出的结论是
。
s,分析表中数据,得出的结论是
。
知识点:化学反应与能量的变化
(1)K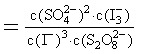
(2)< (Ⅱ)
(3)3∶2
(4)研究![]() 、
、![]() 的浓度对反应速率的影响 22 反应速率与反应物浓度乘积成正比
的浓度对反应速率的影响 22 反应速率与反应物浓度乘积成正比
略
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) ![]() 2B(g)
2B(g) ![]() H=a
H=a ![]() 。其中B的物质的量浓度随时间变化如图所示:
。其中B的物质的量浓度随时间变化如图所示:

试回答下列问题:
(1)已知298 K时60 s达到平衡,则前60 s内A的平均反应速率为 ![]() 。
。
(2)若298 K时B的平衡浓度为A的3倍,则A的转化率为 ,在70 s时再向容器中通入一定量的A气体,再次达到平衡时A的转化率将 (选填”不变”或”变大”或”变小”)。
(3)323 K时(其他条件不变),B的平衡浓度为A的2倍,且达到平衡所需时间为298 K时的![]() 。
。
①该反应中![]() H
0(填”>“或”<“);
H
0(填”>“或”<“);
②请在上图中画出323 K时A的物质的量浓度随时间的变化曲线。
(4)若反应在298 K时进行,在2 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡B的转化率为 。
a.等于60%
b.等于40%
c.小于40%
d.介于40% 60%之间
知识点:化学反应速率和化学平衡
(1)0.005
(2)60% 变小
(3)①<
②

(4)c
略
(2012安徽舒城一中高三月考)自然界里氮的固定途径之一是在闪电的作用下![]() 与
与![]() 反应生成NO。
反应生成NO。
(1)在不同温度下,反应![]()
![]() 2NO(g)
2NO(g)
![]() H=a
H=a ![]() 的平衡常数K如下表:
的平衡常数K如下表:
温度/℃
1 538
1 760
2 404
平衡常数K
0.![]()
2.![]()
![]()
该反应的![]() H
0(填”>““=”或”<“)。
H
0(填”>““=”或”<“)。
②其他条件相同时,在上述三个温度下分别发生该反应。1 538 ℃时![]() 的转化率随时间变化如右图所示,请补充完成1 760 ℃时
的转化率随时间变化如右图所示,请补充完成1 760 ℃时![]() 的转化率随时间变化的示意图。
的转化率随时间变化的示意图。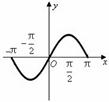
(2)2 404 ℃时,在容积为1.0 L的密闭容器中通入2.6 mol ![]() 和2.6 mol
和2.6 mol ![]() 计算反应
计算反应![]()
![]() 2NO(g)达到平衡时NO的浓度(此温度下不考虑
2NO(g)达到平衡时NO的浓度(此温度下不考虑![]() 与NO的反应。计算结果保留两位有效数字)。
与NO的反应。计算结果保留两位有效数字)。
(3)科学家一直致力于研究常温、常压下”人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下![]() 在催化剂(掺有少量
在催化剂(掺有少量![]() 的
的![]() 表面与水发生反应,生成的主要产物为
表面与水发生反应,生成的主要产物为![]() 。相应的热化学方程式如下:
。相应的热化学方程式如下:
![]() ==
==![]()
![]()
![]() H=+1 530
H=+1 530 ![]()
则氨催化氧化反应![]() ==
==![]() 的反应热
的反应热![]() H=
。(用含a的代数式表示)。
H=
。(用含a的代数式表示)。
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递![]() 实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:
实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:![]()
![]()
![]() 。则在电解法合成氨的过程中,应将
。则在电解法合成氨的过程中,应将![]() 不断地通入 极(填”正”“负” “阴” 或”阳”);在另一电极通入
不断地通入 极(填”正”“负” “阴” 或”阳”);在另一电极通入![]() 该电极反应式为
。
该电极反应式为
。
知识点:基本概念、基本理论的综合运用
(1)①>
②如下图
(2)0.20 ![]()
(3)-(1 530-2a) ![]()
(4)阳 ![]() ===
===![]()
略
在30 ℃时,将0.40 mol的二氧化氮气体充入2 L抽空的密闭容器中,经过10 s达到平衡,浓度变化曲线如下图所示,试回答:

(1)在30 ℃时,反应![]()
![]()
![]() 的
的![]() H
0(填”>“或”<“),你做出这个判断的理由是
。
H
0(填”>“或”<“),你做出这个判断的理由是
。
(2)30 ℃时,反应![]()
![]()
![]() 的平衡常数为
;则升高温度后,平衡常数将
(填”增大”“减小”或”不变”)。
的平衡常数为
;则升高温度后,平衡常数将
(填”增大”“减小”或”不变”)。
(3)若保持温度不变,在第20 s再向该密闭容器中充入0.32 mol He,并把体积扩大为4 L,试通过计算,利用相关数据(不要计算过程,只要相关数据)确定平衡移动的方向为 。
知识点:化学平衡状态及移动
(1)< 该反应为气体体积减小的熵减反应,而此时该反应能自发进行
(2)5 减小
(3) ![]() K=5,平衡向逆反应方向移动
K=5,平衡向逆反应方向移动
略