同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
A.16O和18O是同一种核素
B. 1H218O的摩尔质量为20
C.34S和15N核内的中子数相差9
D. 2H+核外电子数为0
知识点:原子结构与性质
D
略
NA表示阿伏加德罗常数值。下列说法正确的是
A.1mol Cu与足量稀硝酸反应产生NA个NO分子
B.标准状况下, 2.24 L CHCl3的分子数为0.1 NA
C.t℃时,1L pH=6的纯水中,含1×10-6 NA个OH-
D.向FeI2溶液中通入适量氯气,当有1mol Fe2+被氧化时,总共转移电子的数目为1 NA
知识点:物质的量的计算
C
略
3.下列有关物质结构的表述正确的是
A.次氯酸的电子式![]()
![]() B.二氧化硅的分子式SiO2
B.二氧化硅的分子式SiO2
C.二氧化碳的比例模型:![]() D.Cl-的结构示意图:
D.Cl-的结构示意图: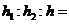
知识点:化学用语
D
略
2011年3月11日日本发生9.0级的强震并引发海啸和核泄露,核电站周围检测到放射性物质碘131,下列有关说法正确的是
A.核裂变是一种化学变化 B.131I 与127I互为同素异形体
C.131I 原子的中子数为78 D.碘在周期表中位于第四周期ⅦA族
知识点:元素周期律与元素周期表
C
略
下列各组离子在碱性条件下能大量共存,且在强酸性条件下能发生氧化还原反应的是
A. Ca2+、Al3+、SO![]() 、Cl— B. K+、Na+、SO
、Cl— B. K+、Na+、SO![]() 、NO
、NO![]()
C. Na+、K+、NO![]() 、SO
、SO![]() D. NH
D. NH![]() 、Na+、Cl—、CO
、Na+、Cl—、CO![]()
知识点:离子共存
B
略
下列指定微粒数目不是1 : 1的是
A.Na2O2晶体中的阳离子和阴离子
B.NaHCO3晶体中的阳离子和阴离子
C.![]() Mg2+离子中的质子和中子
Mg2+离子中的质子和中子
D.醋酸钠溶液中的阳离子总数与阴离子总数
知识点:物质的结构与性质
A
略
下列关于只含非金属元素的化合物的说法中,正确的是
A.一定是共价化合物 B.其晶体有可能是离子晶体
C.其晶体不可能是分子晶体 D.其晶体不可能是原子晶体
知识点:晶体结构与性质
B
略
下列与化学反应能量变化相关的叙述正确的是
A.反应热就是反应放出的热量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应热
D.同温同压下,![]() 在光照和点燃条件下的
在光照和点燃条件下的![]() 不同
不同
知识点:化学反应与能量的变化
C
略
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si
A.只有①③ B.只有②④ C.①②③④ D.①②③④⑤
知识点:元素及其化合物的综合运用
D
略
下列离子方程式中正确的是
A.小苏打溶液中滴加足量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B.向NH4Al(SO4) 2溶液中滴入Ba(OH)2恰好使SO42-反应完全:
2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
C.次氯酸钠溶液中通入SO2气体:2ClO-+SO2+H2O=2HClO+SO32-
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O
知识点:离子方程式
D
略
“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是
A.IVA族元素氢化物熔点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物熔点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3; 则第三周期元素氢化物的
稳定性顺序也是:HCl>H2S>PH3
C.工业上用电解氯化镁制备镁单质,工业上也可用电解氯化铝制备铝单质
D.Fe3O4可改写成氧化物的形式为:FeO·Fe2O3 ;因此Pb3O4也可改写为:PbO·Pb2O3
知识点:元素周期律与元素周期表
B
略
下列说法或表示法正确的是
A.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(1) △H=-285.8kJ·mol-1
B.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
C.根据中和热△H=-57.3kJ·mol-1,可知将含0.5molH2SO4的溶液与含1molNaOH的溶
液混合,放出的热量一定等于57.3kJ
D.由C(s,石墨)→C(s,金刚石) △H= +1.9kJ·mol-1 可知,石墨比金刚石稳定
知识点:化学反应与能量的变化
D
略
氰酸HCNO可消除汽车尾气中的二氧化氮,有关反应的化学方程式为:
8HCNO+6NO2=7N2+8CO2+4H2O,下列叙述中正确的是
A.氮气是还原产物,二氧化碳是氧化产物
B.HCNO中碳元素被氧化
C.1molHCNO参加反应失去3mol电子
D.氧化产物与还原产物物质量比为1:1
知识点:氧化还原反应
C
略
某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体。在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中不正确的是
A.NH5属于离子晶体 B.NH5属于分子晶体
C.NH5与水反应时,NH5是还原剂 D.NH5与NH3溶于水后均呈碱性
知识点:分子结构与性质
B
略
由CO、H2和O2组成的混合气体60ml,在一定条件下恰好完全反应,测得生成物在101KPa、120°C下对空气的相对密度为1.293,则原混合气体中H2所占的体积分数为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
知识点:气体体积的计算
A
略
实验是化学研究的基础。下列关于各实验装置的叙述正确的是
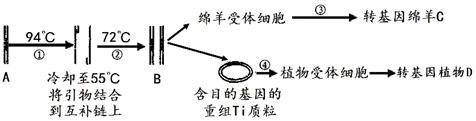
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置③可用于收集H2、CO2、Cl2、NH3等气体
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
知识点:仪器和基本操作
C
略
有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、 NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴别它们,各取少量溶液进行两两混合,实验结果如右表所示。表中“↓”表示生成微溶物或沉淀,“↑”表示生成气体,“—”表示观察不到明显现象,空格表示实验未做。
试推断其中F是

A.Na2CO3溶液
B.BaCl2溶液
C.MgSO4溶液
D.NaHCO3溶液
知识点:离子反应
D
略
在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
知识点:离子反应
B
略
测知氯化钠晶体中相邻的Na+离子与Cl-离子的距离为a cm,该晶体密度为ρg/cm3,则阿伏加德罗常数可表示为
A.0.585/4a3ρ B.58.5/8a3ρ C.58.5/2a3ρ D.117/a3ρ
知识点:物质的量的计算
C
略
一定质量的铁和铜的混合物,与一定浓度的硝酸反应后容器中没有固体剩余,生成标准状况下2.24LNO和4.48LNO2(不考虑N2O4的存在)的混合气体,则参加反应的HNO3的物质的量是
A.0.5 mol B.0.8 mol C.1.0 mol D.1.6 mol
知识点:物质的量的计算
B
略
零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首。
其中最具代表意义的质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔
活性铂电极。下列说法中不正确的是

A. a极为该电池的负极
B. 该电池的正极反应式为O2 + 4H+ + 4e- =2H2O
C. 该电池的能量转化主要形式是化学能转化为电能
D. H+(质子)由正极移动至负极
知识点:原电池
D
略
在120℃和常压下,向100mL CH4和N2的混合气体中通入300mL O2,点燃使其完全反应,最后用足量的过氧化钠固体充分吸收,在相同条件下得到干燥气体340mL,则反应前混合气体中CH4和N2的物质的量之比为
A.1:4 B.1:1 C.1:2 D.2:3
知识点:物质的量的计算
D
略
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧
杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加
NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
知识点:溶液浓度的计算
B
略
在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。
下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分
质量(g)
摩尔质量(g·mol-1)
蔗糖
50.00
342
硫酸钾
0.50
174
阿司匹林
0.35
180
高锰酸钾
0.50
158
硝酸银
0.04
170
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾
C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)_____________mol·L-1。(保留两位有效数字)
(3)配制上述1 L“鲜花保鲜剂”所需的仪器有托盘天平、烧杯、玻璃棒、药匙、________、________。(在横线上填写所缺仪器的名称)
(4)配制过程中,下列操作对配制结果没有影响的是__________。
A.定容时仰视液面
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
知识点:仪器和基本操作

略
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y
的单质是生活中常见的金属,相关物质间的关系如下图所示。

(1) X的单质与A反应的化学方程式是
________________________________________________________________________。
(2) 若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是
________________________________________________________________________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是
________________________________________________________________________
________________________________________________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
________________________________________________________________________。
知识点:无机框图推断
(1)Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
(2)2Al+2H2O+2OH-===2AlO+3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,证明原溶液中含有Fe3+
②Al3++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
③2FeSO4+2NaNO2+H2SO4===2Fe(OH)SO4+Na2SO4+2NO↑(3分)
略