下列说法正确的是( )
A.H、D、T属于同位素,H2、D2、T2属于同素异形体
B.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质
D.水能、风能是可再生能源,煤、石油、天然气是不可再生能源
知识点:基本概念、基本理论的综合运用
D
略
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种一氯代物只有一种,符合该条件的烃可能是( )
A.含7个碳原子的芳香烃 B.相对分子质量为30的烷烃
C.含12个氢原子的烷烃 D.含8个碳原子的芳香烃
知识点:卤代烃
C
略
下列叙述中不正确的是( )
①聚四氟乙烯能使酸性KMnO4溶液褪色 ②烯烃不可能发生取代反应 ③加成反应得到产物是纯净物 ④CH4,C2H6,C3H8一定是烷烃;C2H4,C3H6,C4H8一定是烯烃 ⑤淀粉、纤维素都是天然高分子有机物,其链节都含葡萄糖
A.①②③ B.③④⑤ C.①②③④⑤ D.②③④
知识点:有机化学知识综合应用
C
略
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa c.NaHCO3 d.NaOH,其溶质物质的量浓度由小到大顺序为:d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
A.全部 B.③⑤⑥ C.④⑤⑥ D.①②④
知识点:水的电离和溶液的酸碱性
B
略
类推是化学研究中常用的一种思维方式,下列有关离子反应方程式推理正确的是( )
已 知
推 理
A
向次氯酸钙溶液中通CO2气体:
Ca2+ +2ClO-+CO2+H2O===
CaCO3↓+2HClO
向次氯酸钙溶液中通SO2气体:
Ca2++2ClO-+SO2+H2O===
CaSO3↓+2HClO
B
用惰性电极电解酸铜溶液:
2Cu2++2H2O2Cu+O2↑+4H+
用铜电极电解硫酸铜溶液:
2Cu2++2H2O2Cu+O2↑+4H+
C
稀硫酸与Ba(OH)2溶液反应,pH=7时,
2H++SO+Ba2++2OH-===BaSO4↓+2H2O
硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7时,2H++SO+Ba2++2OH-===
BaSO4↓+2H2O
D
Ba(OH)2溶液逐滴滴入硫酸铝钾溶液至沉淀质量达到最大值:
2Ba2++4OH-+Al3++2SO===
2BaSO4↓+AlO+2H2O
Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:
2Ba2++4OH-+Al3++2SO===
2BaSO4↓+AlO+2H2O
知识点:离子方程式
C
略
短周期元素X,它的最外层实现8电子稳定结构所需的电子数小于次外层电子数和内层电子数之差,且等于最内层电子数的整数倍。下列说法错误的是( )
A. 若X的单质是原子晶体,则1mol该晶体含4mol共价键
B. X最高价氧化物对应的水化物可能是弱酸
C. X形成的氢化物的分子立体构型可能是V形
D. X形成的常见氧化物一定是酸性氧化物
知识点:元素周期律与元素周期表
A
略
下列说法不正确的是
A. ![]() H<0、
H<0、![]() S>0的反应在温度低时不能自发进行
S>0的反应在温度低时不能自发进行
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)
![]() H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 已知25℃时Ksp(AgCl)=1.8![]() 10
10![]() ,则在0.3mol/L NaCl溶液中,Ag+的物质的量浓度最大可达到6.0
,则在0.3mol/L NaCl溶液中,Ag+的物质的量浓度最大可达到6.0![]() 10
10![]() mol/L
mol/L
D. 在其他外界条件不变的情况下,使用催化剂,可以降低活化能,增大活化分子百分数
知识点:溶解平衡
A
略
(12分)有A、B、C、D四种强电解质,它们在水中可电离出下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复)。
![]()
已知:①A、C溶液的pH均大于7,B溶液的PH小于7。②C溶液与D溶液混合后生成白色沉淀;B溶液与C溶液混合后加热有气体生成。
(1)检验B中阳离子的操作方法是_____________________。
(2)若要判断D溶液中的阳离子,可以进一步通过______________实验确定。
(3)25℃时,PH=9的A溶液中水的电离程度_______pH =9的C溶液中水的电离程度(填“ >”、“ < ”或“=”)。
(4)写出单质Al与C溶液反应的离子方程式______________。
(5)将等体积等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________________________________。
(6)25℃时,在一定体积![]() 的C溶液中,加入一定体积的
的C溶液中,加入一定体积的![]() 的盐酸时,混合溶液的pH
= 13。若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是______________。
的盐酸时,混合溶液的pH
= 13。若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是______________。
知识点:盐类水解

略
(16分)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
![]()
(1)已知:![]()
![]()
则 a _______=kJ·mol![]() 。
。
(2)冶炼铁反应的平衡常数表达式K=_______,温度升高后,K值_______ (填“增大"、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K= 64,在2 L恒容密闭容器甲和乙中,分别按下表所示加人物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为_________。
②下列说法正确的是_______ (填字母)。
a. 当容器内气体密度恒定时,表明反应达到平衡状态
b. 甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c. 甲、乙容器中,CO的平衡浓度之比为3:2
d. 增加Fe2O3的量可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。利用下图装置,可以模拟铁的电化学防护,其中Y为NaCl。

①若 X为碳棒,为减缓铁的腐蚀,开关K应置______处(填
字母)。
②若X为锌,开关K置于M处,铁电极发生的电极反应式为_____________________________。
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:![]()
下列叙述正确的是___________ (填字母)。
A.放电时负极反应为:![]()
B.充电时阳极反应为:![]()
C.放电时每转移3mol电子,正极有![]() 被氧化
被氧化
D.放电时正极附近溶液的碱性减弱
知识点:电解池

略
(15分)某研究性学习小组探究氨气的还原性,进行了以下实验。
I.制取氨气
(1)该小组同学用下图装置制取氨气,写出试管A中发生反应的化学方程式:_________________________________________。

(2)有同学用排饱和的氯化铵溶液收集氨气,你认为他_______ (填“能”或“否”)达到实验目的,理由是______________________________________________。
Ⅱ.氨气具有还原性
一定条件下,氨气可与氧化铜反应,反应后得到三种物质,其中有两种单质。某同学设计实验探究氨气还原氧化铜。
(3)请用如图所示的仪器设计一个实验方案,连接顺序为(用接口字母表示)
a---_______----______---_______---________---_______。
(4)浓硫酸的作用是__________;为证明氨气具有还原性可观察到的现象是__________
Ⅲ.测定铜的近似相对原子质量
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,某同学根据反应物CuO的质量[m(CuO)]和生成物H2O的质量[m( H2O)]进行测定:
(5)列出计算Cu的相对原子质量的表达式: ____________________________。
(6)下列情况将使测定结果偏大的是______________。
a. CuO未全部还原为Cu b. CuO受潮 c. CuO中混有铜
知识点:氮族元素

略
[化学--修2:化学与技术](15分)
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含机催化剂(含有v2o5、voso4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
![]()
该工艺的主要流程如下:

请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为______________。
(2)反应①的目的是______________。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式:_____________________。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:![]() ,X为_____________ (写化学式)。
,X为_____________ (写化学式)。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如下图所示。则NH4VO3在分解过程中_______ (填字母)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
知识点:化学与技术

略
[化学--修3:物质结构与性质](15分)
根据题中给出的信息,回答下列问题:
Ⅰ.(1)X、Y是元素周期表中第二周期元素,X的原子序数小于Y。已知:X原子核外没有未成对电子,则X是_______元素(填元素符号);Y的某种氢化物分子的立体结构呈三角锥形,则该分子中心原子的杂化轨道类型为_______,基态Y原子的电子排布图为_________________。
Ⅱ.已知:A、B、C、E四种短周期元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子, C元素的基态原子L层只有2对成对电子,E元素在第三周期元素中电负性最大。D元素的化合物D3C4具有磁性。
(1)分子式为BC2的空间构型为_______________;E元素原子的电子排布式为___________。
(2)某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_________个σ键, 个π键; 其中心原子的杂化类型为_______________。
(3)同质量的A2C晶体的密度小于液体(4℃时)的密度,其原因是__________________。
(4)若向由A、C组成某种化合物的稀溶液中加入少量二氧化锰,有无色气体生成。则该化合物的分子式是_________,属于___________分子(填:“极性”或“非极性”),该反应的化学方程式是__________________________________________。
(5)① D与水蒸气反应的化学方程式为______________________________;
②已知D(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断D(CO)5晶体属于________________ (填晶体类型)。
知识点:晶体结构与性质
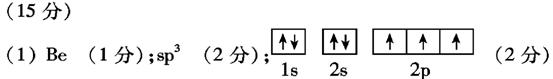 Ⅱ.(1)直线型(1分),1S22S22P63S23P5或[Ne]
3S23P5(2分)
Ⅱ.(1)直线型(1分),1S22S22P63S23P5或[Ne]
3S23P5(2分)
(2)3(1分),2(1分),sp(1分)
(3)冰晶体中存在的氢键使水分子的空间利用率不高,留有较大的空隙。而4℃时,冰的结构部分解体,密度增大。(3分)(其它合理答案均可给分)
(4)H2O2(1分),极性(1分), 2H2O2![]() 2H2O+O2↑(1分)
2H2O+O2↑(1分)
![]() (5)①3Fe+4H2O(g)
Fe3O4+4H2 (2分), ②分子晶体(1分)
(5)①3Fe+4H2O(g)
Fe3O4+4H2 (2分), ②分子晶体(1分)
略
[化学一选修5:有机化学基础](15分)
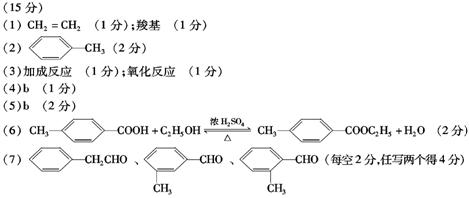
对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体,某兴趣小组利用中学的简单有机物进行合成,C经过一系列反应可以得到D,其方案如下:
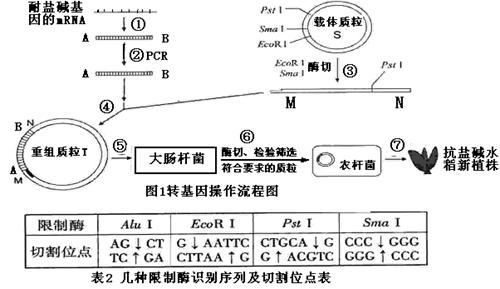
(1)A的结构简式是_______,E中含有的官能团名称是_______。
(2)C为芳香烃,核磁共振氢谱显示有四种峰,C的结构简式是_______。
(3)指出化学反应类型:①_______;②_______。
(4)丁子香酚(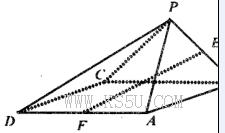 )是一种重要的调味剂,它与F的关系是_______。
)是一种重要的调味剂,它与F的关系是_______。
a.同系物 b.同分异构体 c.同种物质 d.同位素
(5)下列物质不能与丁子香酚发生反应的是______________
a. NaOH溶液 b. NaHCO3溶液 c. Br2的四氯化碳溶液 d. Na2CO3溶液
(6)写出反应③的化学方程式:____________________________。
(7)写出既含有苯环又能够发生银镜反应的D的同分异构体:_____________。 (只写2种)
知识点:有机合成及高分子化合物
略