在实验室中不宜长期保存,必须现用现配的是:①溴水 ②银氨溶液 ③石灰水 ④氯水 ⑤氢硫酸 ⑥NaOH溶液 ⑦FeSO4溶液 ⑧FeCl3溶液 ⑨CuSO4溶液 ⑩醋酸
A.②③④⑧⑨ B.⑤⑦⑧⑨⑩
C.②③④⑤⑦ D.①⑥⑧
知识点:仪器和基本操作
C
略
X2-和Y-两种离子具有相同的电子层结构,则下列关系正确的是
A.原子半径:Y>X B.核电荷数:Y>X
C.离子半径:Y->X2- D.电子层数:X>Y
知识点:元素周期律与元素周期表
A
略
室温下,A、B两物质的溶解度分别为10 g和20 g。取50 g A、B的混合物溶于100 g热水中,然后冷却到室温,若要使A析出而B不析出,则混合物中A的质量分数为
A.大于10% B.大于20%
C.大于40% D.大于60%
知识点:溶液浓度的计算
D
略
把一小块镁、铝合金放入6 mol·L-1的NaOH溶液中,可以形成微型原电池,则该电池负极上发生的电极反应为
A.Mg-2e-===Mg2+
B.Al+4OH--3e-===A1O![]() +2H2O
+2H2O
C.4OH--4e-===2H2O+O2↑
D.2H2O+2e-===2OH-+H2↑
知识点:原电池
B
略
强酸与强碱在稀溶液里反应的反应热可表示为:
H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3 kJ/ mol
已知:CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l);ΔH1
HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l);ΔH2
上述均系在溶液中进行的反应,ΔH1、ΔH2的关系正确的是
A.ΔH1=ΔH2=-57.3 B.ΔH1>ΔH2=-57.3
C.ΔH1<ΔH2<-57.3 D.无法比较
知识点:反应热的计算
B
略
A、B、C、D是由三种常见的短周期元素组成的单质(一种)和化合物(三种),这四种物质相互转变的关系如下图所示,且知:室温下A、B为气态,C为液态,D为固态,则下列叙述正确的是
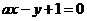
A.D为单质,是硫 B.A为单质,是氮气
C.D为单质,是碳 D.A为单质,是钠
知识点:无机框图推断
A
略
在下列物质的量浓度和体积相同的溶液中,加入少量稀硫酸或稀氢氧化钠溶液,其pH变化最小的是
A.碳酸钠 B.硫化铵
C.氯化钠 D.醋酸铵
知识点:盐类水解
D
略
氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服的作用力与氮化硼熔化时所克服的微粒间的作用力相同的是
A.硝酸钠和金刚石 B.晶体硅
C.冰和水 D.氯化铵
知识点:晶体结构与性质
B
略
在化学研究中,溶液组分的表示还有两种方法:
①质量摩尔浓度=![]() ②摩尔分数=
②摩尔分数=![]()
在某温度范围内,溶液的物态不发生变化。下列溶液组分表示方法中受温度影响的是
A.质量分数 B.物质的量浓度
C.质量摩尔浓度 D.摩尔分数
知识点:溶液浓度的计算
B
略
(5分)离子晶体中阴、阳离子是有规律排布的,X射线测得氯化钠晶体中靠得最近的Na+与Cl-之间的距离d=2.82×10-8 cm,借助这一数据,某化学实验兴趣小组设计了一个测定阿伏加德罗常数的方案。该方案的关键是测定NaCl晶体的密度。
(1)若实验室现有天平、滴定管(25 mL)、容量瓶(25 mL)等仪器,试设计一个测定NaCl晶体密度的方案 (NaCl晶体己研细,其他试剂自选)。
(2)经测定NaCl晶体的密度为ρ,摩尔质量为M,试写出计算阿伏加德罗常数的公式。(式中物理量都用字母表示)。
知识点:晶体结构与性质
(5分)(1)用天平准确称量已经研细的食盐m克,小心地加入到容量瓶中。在滴定管中加一定量的水,记下读数V1 mL,然后向容量瓶中加水至刻度线,记下滴定管中用水的读数V2 mL。用容量瓶的体积减去滴定管中所用的水量即为食盐的体积。
ρ=![]() (3分)
(3分)
(2)NA=m/[ρM(2.82×10-8)3] (2分)
略
(7分)实验室用浓盐酸、MnO2共热制C12,并用C12和Ca(OH)2反应制少量漂白粉。现已知反应C12+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应6C12+6Ca(OH)2===Ca(ClO3)2+5CaCl2+6H2O。现有三个同学分别设计的三套实验装置如下图所示。

(1)有下列几项优、缺点:a、不容易控制反应速率;b、容易控制反应速率;c、有副反应发生;d、可防止副反应发生;e、污染环境;f、可防止污染环境。
请从上面几个方面对上图所示的甲、乙、丙三套装置的优缺点作出评价,选择符合题目要求的选项填入下表空格内。
优点 缺点
①甲装置
②乙装置
③丙装置
(2)上图所示装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。请从图中A~G各部分装置中选取合理的组成部分,组装成一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是 。
知识点:卤素
(7分)(1)①d ae ②f ac ③b ce(每空2分)
(2)F→B→E(1分)
略
(7分)现有下列短周期元素性质的数据:
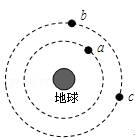 试回答下列问题:
试回答下列问题:
(1)上述元素中处于同一主族的有 ,元素②在周期表中的位置为 。
(2)上表中某两种元素形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式 。
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式: 。
(4)元素⑧的单质的基本结构单元为如下图所示的正二十面体的空间构型,其中有20个等边三角形的面和一定数目的顶角,每个顶点各有一个原子。此基本结构单元由 个原子构成。
知识点:晶体结构与性质
(7分)(1)③⑥、④⑦(各(1分)) 第三周期第ⅡA族 (1分)

(3)2Na2O2+2H2O===4Na++4OH-+O2↑ (2分)
(4)12 (1分)
略
(8分)麻醉剂的发现和使用是人类医疗史上了不起的一项成就,它可使患者接受治疗时感觉不到疼痛,笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外,还有一种很常见的化合物,试写出该反应的化学方程式: ,若产生1 mol N2O,则转移电子 mol。有关理论认为N2O与CO2分子具有相似的结构,两者电子数相等,已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式为 ,其空间构型是 型。
知识点:分子结构与性质
(8分)NH4NO3![]() N2O+H2O
4
N2O+H2O
4
![]()
略
(5分)两种化合物A和B都只含C、H、O三种元素,A和B的物质的量以任何比例混合,完全燃烧后生成的CO2的体积是消耗O2体积的2倍(同温同压测定);A和B的分子量分别是a和b,且a>b。
(1)若A、B分子中氢原子数相同,A、B分子量的差值一定是 的整数倍(填一个数字)。
(2)写出与B(符合上述条件且分子数量小的化合物B)分子量相差14,且不属于同类物质的两种分子的结构简式: , 。
(3)试写出符合上述条件且分子量最小的化合物A的化学式: ,其结构简式为 。
知识点:羧酸和酯
(5分)(1)28 (1分)
(2)CH3COOH HCOOCH3 (各1分)
(3)C2H2O3 (HCO)2O(甲酸酐) (各1分)
略
(9分)去年9月底,国家质检总局查处了在食品中使用“吊白块”七大案例。“吊白块”化学名称为甲醛次硫酸氢钠,违法者往食品中添加“吊白块”是为了漂白增色、防腐、增加米面制品的韧性及口感。但人食用“吊白块”后刺激肠道,引起过敏和食物中毒,容易致癌。已知“吊白块”是由甲醛和次硫酸氢钠(可表示成Na+〔OSOH〕-)反应制得:

回答下列问题:
(1)“吊白块” (填“易”“微”“难”)溶于水。
(2)写出水溶液中次硫酸氢钠和KOH反应的离子方程式 。
(3)甲醛是非常重要的合成原料。纯净的甲醛在配位化合物〔F3B←O(CH2CH3)2〕的催化下,生成优良的工程塑料聚甲醛,聚甲醛的结构简式为 。
(4)已知:C+H2O![]() 某混合气体M
某混合气体M
HCHO+某混合气体M![]() A
A![]() B
B
其中A可还原新制的Cu(OH)2悬浊液,亦可与乙酸发生酯化反应;B的相对分子质量是HCHO的整数倍,自然界中常以盐的形式存在于多种植物的细胞膜中,B可洗除衣物上的铁锈渍。
则:①A的结构简式为 ,B的结构简式为 。
②写出B被酸性KMnO4溶液彻底氧化的离子方程式: 。
知识点:乙醛和醛类
(9分)(1)易 (1分)
(2)HSO![]() +OH-===SO
+OH-===SO![]() +H2O (2分)
+H2O (2分)![]() (2分)
(2分)
(4)①HOCH2CHO HOOCCOOH (各1分)
②5HOOCCOOH+2MnO![]() +6H+
+6H+![]() 2Mn2++10CO2↑+8H2O (2分)
2Mn2++10CO2↑+8H2O (2分)
略
(7分)将m mol Na2O2和n mol NaHCO3固体混合物放在密闭容器中加热至250℃,充分反应后排放出气体。
(1)填下表;
m/n
剩余固体
排出气体
①
Na2CO3
O2、CO2、H2O(g)
②
1/2
③
1/2~1
④
⑤
Na2CO3、NaOH、Na2O2
(2)当排出气体只含O2和H2O(气体)且两者物质的量相等时,问原来固体混合物中m∶n= 。
知识点:钠和碱金属
(7分)
|
|
m/n |
剩余固体 |
排出气体 |
|
① |
< |
|
|
|
② |
|
Na2CO3 |
O2、H2O(g) |
|
③ |
|
Na2CO3、NaOH |
O2、H2O(g) |
|
④ |
1 |
Na2CO3、NaOH |
O2 |
|
⑤ |
< |
|
O2 |
略
(7分)有一硫酸和硝酸的混合溶液,取出其中的10 mL,加入足量的BaCl2溶液,过滤、洗涤、烘干后得到9.32 g固体;滤液跟4 mol·L-1的NaOH溶液反应,用去35 mL碱液时恰好中和。
(1)求混合溶液中硫酸、硝酸溶液的物质的量浓度。
(2)另取10 mL原混合酸溶液,加入3.2 g Cu粉共热,在标准状况下收集到多少毫升气体?
知识点:溶液浓度的计算
(1)H2SO4~BaSO4
1 233
x 9.32 g
x=0.04 mol
c(H2SO4)=0.04/0.01=4 mol·L-1 (2分)
又∵H+ ~ OH-
1 1
Y×0.01 4×0.035
∴Y=14 mol·L-1
∴c(HNO3)=14-4×2=6 mol·L-1 (2分)
(2)∵3Cu+2NO![]() +8H+===3Cu2++2NO↑+4H2O
+8H+===3Cu2++2NO↑+4H2O
∴n铜=0.05 mol NO![]() 、H+均过量 (2分)
、H+均过量 (2分)
VNO=![]() ×0.05×22.4=0.747 L (1分)
×0.05×22.4=0.747 L (1分)
略