NA代表阿伏加德罗常数,下列说法正确的是( )
A.同一物质的固、液、气三种状态的熵相同
B.0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移
C.等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等
D.1.5 mol NO2与足量H2O反应,转移的电子数为2NA
知识点:物质的量的计算
C
考点:阿伏加德罗常数.
分析:A.固态时熵值最小,气态时熵值最大;
B.先判断过量,然后根据不足量计算出转移的电子数目;
C.根据电子守恒进行判断;
D.二氧化氮既是氧化剂也是还原剂,1.5mol二氧化氮与水反应生成1mol硝酸.
解答:解:A.同种物质在固态、液态、气态三种状态下,固态时熵值最小,气态时熵值最大,故A错误;
B.0.1mol铁完全反应需要消耗0.15mol氯气,氯气不足,反应转移的电子按照氯气的物质的量计算,0.1mol氯气完全反应转移0.2mol电子,转移的电子数为0.2NA,故B错误;
C.等物质的量的钠分别在足量的氧气和氯气中燃烧,钠失去的电子的物质的量相等,转移的电子数相等,故C正确;
D.1.5 mol NO2与足量H2O反应,生成1mol硝酸,转移1mol电子,转移的电子数为NA,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数,注意过氧化钠与水的反应、二氧化氮与水的反应,既是氧化剂也是还原剂,本题难度不大.
下列各组离子,能在指定溶液中大量共存的是( )
①无色溶液中:K+、Cl﹣、Na+、HCO3﹣、OH﹣
②使pH试纸变深蓝的溶液中:K+、CO32﹣、Na+、AlO2﹣
③水电离的c(H+)=10﹣12mol/L的溶液中:ClO﹣、CO32﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、Na+、SO42﹣
⑤使甲基橙变红的溶液中:MnO4﹣、NO3﹣、SO42﹣、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
A.①③④ B.②④⑤ C.①②⑤ D.②③⑥
知识点:离子共存
B
考点:离子共存问题.
专题:离子反应专题.
分析:根据离子之间不能结合生成水、气体、沉淀、弱电解质等,不能发生氧化还原反应,则能大量共存,以此来解答.
解答:解:①HCO3﹣、OH﹣结合生成水和碳酸根离子,不能共存,故错误;
②使pH试纸变深蓝的溶液,显碱性,该组离子之间不反应,能共存,故正确;
③水电离的c(H+)=10﹣12mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在ClO﹣、CO32﹣、SO32﹣,碱溶液中不能大量存在NH4+,故错误;
④加入Mg能放出H2的溶液,显酸性,该组离子之间不反应,能共存,故正确;
⑤使甲基橙变红的溶液,显酸性,该组离子之间不反应,能共存,故正确;
⑥pH=0的溶液,显酸性,Fe2+、H+、NO3﹣发生氧化还原反应,不能共存,故错误;
故选B.
点评:本题考查离子的共存,为高考常见题型,侧重信息的抽取和离子之间反应的考查,注重学生思维严密性的训练,有利于提高学生分析问题解决问题的能力,题目难度不大.
根据表中信息判断,下列选项错误的是( )
反应序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4…
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4﹣…
Cl2、Mn2+…
A.反应①的其余产物为H2O和O2
B.反应②中Cl2与FeBr2的物质的量之比为1:2
C.反应③中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为Cl2>MnO4﹣>Br2
知识点:氧化还原反应
D
考点:氧化还原反应.
专题:氧化还原反应专题.
分析:A.根据元素守恒和电子守恒判断;
B.②中溴元素的化合价没有变化,即Cl2只将Fe2+氧化,根据化合价变化判断;
C.③中MnO4﹣被还原成Mn2+,则Cl﹣被氧化为Cl2,据此判断;
D.根据氧化剂的氧化性大于氧化产物的氧化性判断.
解答:解:A.Mn元素被还原,故H2O2被氧化,生成O2,则发生的反应为反应为KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2↑+H2O,故A正确;
B.②中溴元素的化合价没有变化,即Cl2只将Fe2+氧化,则发生的反应为:3Cl2+6FeBr2=2FeCl3+4FeBr3,则Cl2与FeBr2的物质的量之比为1:2,故B正确;
C.③中MnO4﹣被还原成Mn2+,则Cl﹣被氧化为Cl2,Cl元素从﹣1价升高到0价,转移的电子数为1,则生成1 mol Cl2,转移电子2 mol,故C正确;
D.③中MnO4﹣被还原成Mn2+,Cl﹣被氧化为Cl2,则氧化性MnO4﹣>Cl2,所以氧化性由强到弱的顺序为MnO4﹣>Cl2>Br2,故D错误.
故选D.
点评:本题考查了氧化还原反应中电子转移和化合价升降之间的关系知识,注意知识的归纳和整理是关键,题目难度中等.
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol•L﹣1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A.1:1:4 B.1:3:1 C.3:3:8 D.1:1:1
知识点:铁及其化合物
A
考点:铁的化学性质;有关混合物反应的计算.
专题:图示题;压轴题.
分析:-某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,由图可知,加入1molFe,亚铁离子的浓度的不变,则发生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,再加入1molFe发生Fe+2Fe3+═3Fe2+,再加铁粉时亚铁离子的浓度增加,发生Fe+Cu2+═Fe2++Cu,以此来解答.
解答:-解:某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,由图可知,加入1molFe,亚铁离子的浓度的不变,
则发生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,
1 4 1
再加入1molFe发生Fe+2Fe3+═3Fe2+,
1 2 3
所以n(HNO3)=4mol,原溶液中硝酸铁的物质的量n(Fe3+)=2mol﹣1mol=1mol,
再加铁粉时亚铁离子的浓度增加,
发生Fe+Cu2+═Fe2++Cu,
1 1
所以n(Cu2+)=1mol,
即溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1:1:4,
故选A.
点评:本题考查铁的化学性质,明确图象中每段发生的化学反应是解答本题的关键,注意反应与图象的对应关系来解答,题目有一定难度,特别是溶液中铁离子浓度的判断.
对下列化学用语的理解正确的是( )
A.原子结构示意图 可以表示12C,也可以表示14C
可以表示12C,也可以表示14C
B.比例模型 可以表示二氧化碳分子,也可以表示水分子
可以表示二氧化碳分子,也可以表示水分子
C.电子式 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
D.分子式C2H4O2可以表示乙酸,也可以表示乙二醇
知识点:化学用语
A
考点:电子式、化学式或化学符号及名称的综合.
专题:化学用语专题.
分析:A.同位素的质子数、核外电子数相同,中子数不同;
B.二氧化碳是直线型分子,水分子在V型分子;
C.氢氧根离子带一个单位的负电荷;
D.乙酸中含有碳氧双键,乙二醇中所有原子都达到饱和.
解答:解:A.同位素的质子数和核外电子数相同,所以其原子结构示意图相同,故A正确;
B.二氧化碳是直线型分子,水分子在V型分子,该比例模型是水分子模型,故B错误;
C.氢氧根离子的电子式为: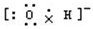 ,羟基的电子式为
,羟基的电子式为 ,故C错误;
,故C错误;
D.乙酸的分子式为:C2H4O2 ,乙二醇的分子式为C2H6O2,故D错误;
故选A.
点评:本题考查化学用语,易错选项是C,注意氢氧根离子和羟基的区别,为易错点.
(双选题)在可逆反应2A(g)+3B(g) xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol•L﹣1,B为3mol•L﹣1,前2min内C的平均反应速率为0.5mol•L﹣1•min﹣1.2min后,测得D的浓度为0.5mol•L﹣1.则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol•L﹣1,B为3mol•L﹣1,前2min内C的平均反应速率为0.5mol•L﹣1•min﹣1.2min后,测得D的浓度为0.5mol•L﹣1.则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5:3
B.x=2
C.2 min末时B的浓度为1.5 mol•L﹣1
D.2 min末时A的消耗浓度为0.5 mol•L﹣1
知识点:化学反应速率
BC
考点:化学平衡的计算.
专题:化学平衡专题.
分析:根据化学反应速率之比等于系数之比,结合化学反应的三段式计算:
A(g)+3B(g)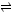 xC(g)+D(g)
xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
结合初始浓度、变化浓度、末态浓度进行计算即可,化学反应速率v= .
.
解答:解:2A(g)+3B(g)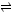 xC(g)+D(g)
xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
A、2min末时,A和B的浓度之比为4:1.5=8:3,故A错误;
B、C的反应速率为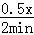 mol/(L•min)=0.5mol/(L•min),解得x=2,故B正确;
mol/(L•min)=0.5mol/(L•min),解得x=2,故B正确;
C、2min末时,B的浓度=1.5mol/L,故C正确;
D、2min末时,A的消耗浓度为1mol/L,故D错误.
故选BC.
点评:本题考查学生有关化学平衡和化学反应速率的有关计算知识,属于考查的重点内容,注意三行式在解题中的灵活应用,难度不大.
一定条件下存在反应:2SO2(g)+O2(g)═2SO3(g),△H<0.现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在400℃条件下开始反应.达到平衡时,下列说法正确的是( )

A.容器Ⅰ、Ⅲ中平衡常数相同
B.容器Ⅱ、Ⅲ中正反应速率相同
C.SO3的体积分数:Ⅱ<Ⅲ
D.容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
知识点:化学平衡状态及移动
D
考点:化学平衡的计算.
分析:A、容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行;
B、容器Ⅱ是恒温恒容,Ⅲ是恒压容器,反应过程中随着SO2转化为SO3,容器Ⅱ的压强会增大,反应速率会比容器Ⅲ大;
C、容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,Ⅱ>Ⅲ;
D、若容器Ⅱ恒温恒容,容器Ⅰ是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,实际容器Ⅰ是绝热恒容,随着反应的进行,温度升高,平衡逆向进行,二氧化硫转化率减小.
解答:解:A、容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,平衡常数减小,容器Ⅰ、Ⅲ中平衡常数不相同,故A错误;
B、容器Ⅲ是恒压容器,反应过程中压强大于容器Ⅰ,反应速率大,容器Ⅱ、Ⅲ中正反应速率不相同,故B错误;
C、容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,SO3的体积分数:Ⅱ>Ⅲ,故C错误;
D、若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故D正确;
故选D.
点评:本题考查了影响化学平衡因素的分析判断,注意容器的条件分析应用,绝热容器使体系温度升高,掌握基础是关键,题目难度中等.
下列说法正确的是( )

A.图(a)中,随着电解的进行,溶液中H+的浓度越来越小
B.图(b)中,Mg电极作电池的负极
C.图(c)中,发生的反应为Co+Cd2+=Cd+Co2+
D.图(d)中,K分别与M、N连接时,Fe电极均受到保护
知识点:原电池
D
考点:原电池和电解池的工作原理.
专题:电化学专题.
分析:A.图a中,实际上为电解水;
B.图b中,铝与氢氧化钠溶液发生反应,铝发生氧化反应,原电池负极发生氧化反应;
C.图c中,负极上失电子,正极上得电子,较活泼的金属为负极,较不活泼的金属为正极,据此写出电池反应式;
D.图d中,K与M连接,连接电源的负极,Fe作阴极被保护,K分别与N连接,形成原电池,Fe为正极被保护.
解答:解:A.图a中,阳极上氢氧根离子失电子,阴极上氢离子放电,溶液中氢离子浓度增大,故A错误;
B.图b中,铝与氢氧化钠溶液发生反应,铝发生氧化反应,原电池负极发生氧化反应,铝作负极,故B错误,
C.图c中,负极上失电子,发生氧化反应,正极上得电子,发生还原反应,Cd为负极,故金属活泼性Cd>Co,故发生的反应为Cd+Co2+=Co+Cd2+,故C错误;
D.图d中,K与M连接,连接电源的负极,Fe作阴极被保护,K与N连接,形成原电池,Fe为正极被保护,故D正确;
故选D.
点评:本题综合考查电解池和原电池知识,注意把握电化学工作原理,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.
(10分)如图是中学常见物质间的转化关系.已知:
(a)A为淡黄色固体,B为导致“温室效应”的主要物质;
(b)E为常见金属,J为红褐色沉淀;
(c)G在实验室中常用于检验B的存在;
(d)L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色.回答下列问题:

(1)A的电子式 .
(2)反应①的化学方程式为 ,反应②的离子方程式为 ,
(3)若参加反应的A的质量为39g,则转移的电子数目为 .
(4)向含n g L的稀溶液中加入m g E,两者恰好完全反应,若L只被还原为+2价化合物,则n:m不可能为 .
A.5:1 B.9:2 C.3:1 D.4:1.
知识点:无机框图推断
(1) ;
;
(2)2Na2O2+2CO2=2Na2CO3+O2↑;Fe3++3OH﹣=Fe(OH)3↓;
(3)0.5NA;
(4)A.
考点:无机物的推断.
专题:推断题.
分析:A为淡黄色固体,B为导致“温室效应”的主要物质,二者反应生成,则A为Na2O2,B为CO2,二者反应生成Na2CO3和O2,G在实验室中常用于检验CO2的存在,则G为从Ca(OH)2,故C为O2,D为Na2CO3,金属E经过系列反应得到J为红褐色沉淀,则J为Fe(OH)3,E为Fe,F为Fe3O4,L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色,应是浓硝酸所具有的性质,则L为HNO3,K为Fe(NO3)3,H为NaOH,I为CaCO3,据此解答.
解答:解:A为淡黄色固体,B为导致“温室效应”的主要物质,二者反应生成,则A为Na2O2,B为CO2,二者反应生成Na2CO3和O2,G在实验室中常用于检验CO2的存在,则G为从Ca(OH)2,故C为O2,D为Na2CO3,金属E经过系列反应得到J为红褐色沉淀,则J为Fe(OH)3,E为Fe,F为Fe3O4,L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色,应是浓硝酸所具有的性质,则L为HNO3,K为Fe(NO3)3,H为NaOH,I为CaCO3,
(1)由上述分析可知,A为Na2O2,电子式为 ,故答案为:
,故答案为: ;
;
(2)反应①的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2↑,反应②的离子方程式为:Fe3++3OH﹣=Fe(OH)3↓,故答案为:2Na2O2+2CO2=2Na2CO3+O2↑;Fe3++3OH﹣=Fe(OH)3↓;
(3)n(Na2O2)=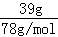 =0.5mol,由2Na2O2+2CO2=2Na2CO3+O2,可知生成氧气为0.25mol,故转移电子为0.25mol×2=0.5mol,即转移电子数目为0.5NA,故答案为:0.5NA;
=0.5mol,由2Na2O2+2CO2=2Na2CO3+O2,可知生成氧气为0.25mol,故转移电子为0.25mol×2=0.5mol,即转移电子数目为0.5NA,故答案为:0.5NA;
(4)向含n g HNO3的稀溶液中加入m g Fe,两者恰好完全反应,若HNO3只被还原为+2价化合物,即生成NO,当生成Fe(NO3)3时,Fe的质量最小,则:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,n:m的最大值=4×63:56=9:2,当生成Fe(NO3)2时,Fe的质量最大,则:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,n:m的最小值=8×63:3×56=3:1,故3:1≤n:m≤9:2,故选A.
点评:本题考查无机物推断,题目难度中等,物质的颜色及特殊反应是推断突破口,注意对元素化合物的性质掌握,(4)注意利用极限法进行分析解答.
(10分)在体积为1L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
T/℃
700
800
850
1 000
1 200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)该反应的平衡常数表达式K= ,升高温度,化学平衡向 (填“正反应”或“逆反应”)方向移动.
(2)能判断该反应达到化学平衡状态的依据是 .
A.c(CO2)=c(CO)
B.K不变
C.容器中的压强不变
D.v正(H2)=v正(CO2)
E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:[CO2]•[H2]=[CO]•[H2O],此时的温度为 ;在此温度下,若向该容器中投入1mol CO2、1.2mol H2、0.75mol CO、1.5mol H2O,则此时反应朝 方向进行(填“正反应”、“逆反应”).
知识点:化学平衡状态及移动
(1) ;正反应
;正反应
(2)E;
(3)850℃;正反应.
考点:化学平衡建立的过程;化学平衡的影响因素;化学平衡状态的判断.
专题:化学平衡专题.
分析:(1)依据化学方程式和平衡常数概念书写平衡常数表达式;依据平衡常数随温度升温增大,说明平衡正向移动;
(2)依据判断平衡状态的方法来判断即正逆反应速率相同,各组分含量保持不变;
(3)依据平衡常数计算式和图表数据分析判断;
解答:(1)由CO2(g)+H2(g)⇌CO(g)+H2O(g),反应的平衡常数K=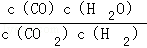 ;依据表格数据说明平衡常数随温度升温增大,说明平衡正向移动;
;依据表格数据说明平衡常数随温度升温增大,说明平衡正向移动;
故答案为: ;正反应
;正反应
(2)A.c(CO2)=c(CO)和起始量和消耗量有关,不能说明反应达到平衡状态,故A错误;
B.平衡常数仅与温度有关,温度一定K就不变,所以K不变不能说明达到平衡状态,故B错误;
C.反应前后气体体积不变,反应过程中和平衡状态压强都不变,容器中压强不变不能说明达到平衡状态,故C错误;
反应速率之比等于化学方程式系数之比,是正反应速率之比,υ正(H2)=υ逆(H2O) 表面水的正逆反应速率相同,反应达到平衡状态,故C正确;
D.v正(H2)=v正(CO2)都是指的正反应方向,不能说明正逆反应速率相同,故D正确;
E.混合气体中 c(H2)不变是平衡标志,故E正确;
故答案为:E;
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),K=1,依据图表数据可知,平衡常数随温度变化,温度不变,平衡常数不变,判断此时的温度为850℃;在此温度下,若向该容器中投入1mol CO2、1.2mol H2、0.75mol CO、1.5mol H2O则有Qc=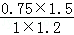 =0.9375<1,所以反应向正反应方向进行;
=0.9375<1,所以反应向正反应方向进行;
故答案为:850℃;正反应.
点评:本题考查化学平衡的影响因素,题目难度中等,解答时首先分析化学方程式的特征,特别是反应前后气体的化学计量数关系以及反应的吸、放热问题.
(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是: .
(2)石墨电极(C)的电极反应式为 .
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体体积为 L.
(4)铜丝a处在开始一段时间的现象为 ;原因是 .
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 .
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为 .
知识点:原电池
(1)CH4﹣8e﹣+10OH﹣═CO23﹣+7H2O;
(2)2Cl﹣﹣2e﹣═Cl2↑;
(3)4.48;
(4)溶液变红;由于2H++2e﹣=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红;
(5)bd;
(6)4H++O2+4e﹣═2H2O.
考点:原电池和电解池的工作原理.
专题:电化学专题.
分析:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应;
(3)根据串联电池中转移电子数相等计算铁电极上生成氢气的体积;
(4)a为阴极,阴极发生还原反应生成氢气,促进水的电离;
(5)铜的精炼时,粗铜为阳极,纯铜为阴极;
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,铜被氧化,应为负极,正极上氧气被还原.
解答:解:(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O.
故答案为:CH4﹣8e﹣+10OH﹣═CO23﹣+7H2O;
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl﹣﹣2e﹣=Cl2↑,
故答案为:2Cl﹣﹣2e﹣═Cl2↑;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量= ×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
2H++2e﹣=H2↑
2mol 22.4L
0.4mol xL
x=4.48,
故答案为:4.48;
(4)a为阴极,发生2H++2e﹣=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红,
故答案为:溶液变红;由于2H++2e﹣=H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红;
(5)电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能.电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应.电解时,溶液中的阳离子向阴极移动,在阴极上得电子.粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近.此题应选b、d;
故答案为:bd;
(6)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,铜被氧化,应为负极,正极上氧气被还原,电极方程式为4H++O2+4e﹣═2H2O,
故答案为:4H++O2+4e﹣═2H2O.
点评:本题综合考查电解池和原电池知识,注意把握电化学工作原理,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.