下列反应属于放热反应的是( )
①稀硫酸与氢氧化钾溶液反应②锌与稀硫酸的反应③生石灰变成熟石灰的反应④消石灰和氯化铵晶体混合反应⑤石灰石高温煅烧⑥灼热的炭与CO2反应⑦甲烷与O2的燃烧反应
A.①②③⑤ B.①②③⑦ C.①②⑤⑥⑦ D.④⑥
知识点:化学反应与能量的变化
B
略
下列叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.分解反应一定是吸热反应
C.应用盖斯定律,可计算某些难以直接测量的反应的焓变
D.同温同压下,H2(g)+Cl2(g)====2HCl(g)在光照和点燃条件下的ΔH不同
知识点:化学反应与能量的变化
C
略
下列关于能量判据和熵判据的说法中,不正确的是( )
A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B.由能量判据和熵判据组合成的复合判据,将更适合于所有的过程
C.在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1 200 K)下则能自发进行
D.放热过程(ΔH<0)或熵增加(ΔS>0)的过程一定是自发的
知识点:化学反应进行的方向
D
略
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金作阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是( )
A.Y>Z>W>X B.Z>Y>W>X C.W>Z>Y>X D.X>Y>Z>W
知识点:元素周期律与元素周期表
B
略
下列有关平衡常数的说法中,正确的是( )
A. 平衡常数为![]() 的反应,化学方程式为CO2+H2
的反应,化学方程式为CO2+H2![]() CO+H2O
CO+H2O
B.反应2NO2(g) ![]() N2O4(g) ΔH<0,升高温度,该反应平衡常数增大
N2O4(g) ΔH<0,升高温度,该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D.改变条件,反应物的转化率增大,平衡常数也一定增大
知识点:化学平衡状态及移动
A
略
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解为PCl3和Cl2是可逆反应。下列说法正确的是( )
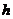
A.其他条件不变,升高温度有利于PCl5生成
B.反应2P(s)+5Cl2(g)=====2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1
C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)==2PCl3(g)ΔH=-306 kJ·mol-1
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K减小
知识点:基本概念、基本理论的综合运用
B
略
若将反应:Zn+H2SO4====ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
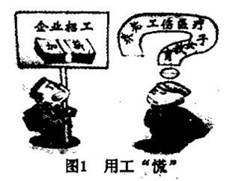
A.d溶液是稀硫酸 B.c溶液颜色变蓝
C.b极发生氧化反应 D.a极是铜棒
知识点:原电池
A
略
能够使反应Cu+2H2O====Cu(OH)2+H2↑发生的是( )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠水溶液
D.用铜片作阴、阳电极,电解硫酸铜水溶液
知识点:电化学基础
C
略
下列说法正确的是( )
A.钢铁发生电化学腐蚀时,负极发生的反应是: Fe-3e-====Fe3+
B.将钢铁与电源的正极相连,可防止其被腐蚀
C.在镀件上镀铜时可用金属铜作阴极
D.用电解法精炼粗铜时粗铜作阳极
知识点:金属的电化学腐蚀与防护
D
略
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g) ![]() C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度③B的物质的量浓度
④气体的总物质的量 ⑤混合气体总质量
A.②③⑤ B.①②③ C.②③④ D.①③④⑤
知识点:化学平衡状态及移动
A
略
一定条件下,通过下列反应可实现燃煤烟气中硫的回收: SO2(g)+2CO(g)
![]() 2CO2(g)+S(l)
△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是(
)
2CO2(g)+S(l)
△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是(
)
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其它条件不变,分离出硫,平衡正移
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其它条件不变,使用不同催化剂,该反应的平衡常数不变
知识点:化学平衡状态及移动
D
略
一种充电电池放电时的电极反应为:H2+2OH--2e-====2H2O; NiO(OH)+H2O+e-====Ni(OH)2+OH-当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A. Ni(OH)2的氧化 B.NiO(OH)的还原 C.H2的氧化 D. H2O的还原
知识点:电化学基础
A
略
已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
t/℃
700
800
830
1 000
1 200
K
1.67
1.11
1.00
0.60
0.38
下列有关叙述不正确的是( )
A.该反应的化学方程式是:CO(g)+H2O(g)
![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到
830 ℃,此时测得CO2为0.4 mol 时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式:![]() ,判断此时的温度是1 000 ℃
,判断此时的温度是1 000 ℃
知识点:化学平衡状态及移动
C
略
关于下列各装置图的叙述中,不正确的是( )

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
知识点:电化学基础
B
略
用二根铂丝作电极插入KOH溶液中,分别向两极通入甲烷和氧气,可作为一种燃料电池的模拟装置。试判断下列说法正确的是( )
A.通氧气的铂极为负极 B.此电池反应为CH4+2O2====CO2+2H2O
C.此电池放电时,KOH浓度减小
D.此电池放电时,电子由负极通过电解质溶液移向正极
知识点:原电池
C
略
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH=-746.8 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中
N2(g)+2CO2(g) ΔH=-746.8 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中
一个条件X,Y随X的变化,符合图中曲线的是( )
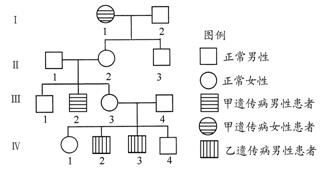
A.当X表示温度时,Y表示平衡常数K
B.当X表示温度时,Y表示CO的转化率
C.当X表示N2的物质的量时,Y表示NO的转化率
D.当X表示NO的物质的量时,Y表示平衡常数K
知识点:化学平衡状态及移动
D
略
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应: Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是(
)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是(
)

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
知识点:化学平衡状态及移动
D
略
依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,3molNO2气体与足量的水反应生成硝酸和NO气体放热138KJ.________________________________________________________。
(2)已知拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________。
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)====CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)====2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式 __。
知识点:化学反应的热效应
(1)3NO2(g)+H2O(l)―=2HNO3(aq)+NO(g) ΔH=-138 kJ·mol-1
(2)N2(g)+3H2(g)
![]() 2NH3(g) ΔH=-92
kJ·mol-1
2NH3(g) ΔH=-92
kJ·mol-1
(3)CH4(g)+2H2O(g)====CO2(g)+4H2(g) ΔH=+165 kJ·mol-1
略
在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72—与黄色的CrO42—有以下平衡关系:Cr2O72— (aq) + H2O(l)![]() 2CrO42— (aq) + 2H+(aq)
2CrO42— (aq) + 2H+(aq)
(1)写出上述反应的平衡常数表达式:K=_______________________
(2)向重铬酸钾中加入少量NaOH固体,溶液呈_________色。
(3)向(2)所得的溶液中加入过量的稀硫酸,则溶液呈________色,因为____________
____________________________________________________________________________
(4)向原溶液中加入Ba(NO3)2溶液(Ba CrO4为难溶性黄色沉淀),则平衡_________
_____________(填“正向移动”、“逆向移动”或“不移动”),溶液颜色将_______________
知识点:化学平衡状态及移动
(1)K=[ CrO42—]2[H+]2/[ Cr2O72—]
(2)黄
(3)橙红色 加入酸,H+浓度增大,平衡左移,Cr2O72—浓度增大,溶液呈橙红色
(4)正向移动 变浅
略
已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃
700
900
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
回答下列问题:
(1)△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A浓度变化0.018 mol·L-1。则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为
。
A(g)+B(g)的平衡常数的值为
。
知识点:化学平衡状态及移动
(1) <
(2)0.022 mol·L-1 0.09mol 80% 80%
(3)c
(4)2.5
略
某课外活动小组用如图装置进行实验,试回答下列问题。
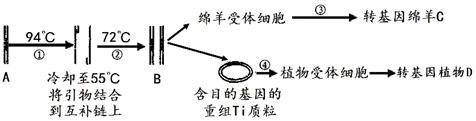
(1)若开始时开关K与a连接,则B极的电极反应式为__________。
(2)若开始时开关K与b连接,则B极的电极反应式为____________,
总反应的离子方程式为_________________________________。
有关上述实验,下列说法正确的是(填序号)______________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_______________________。
此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为__________________。
知识点:电化学基础
(1)Fe-2e-====Fe2+
(2)2H++2e-====H2↑
2Cl-+2H2O2OH-+H2↑+Cl2↑ ②
(3)①4OH--4e-====2H2O+O2↑ 小于
②O2+2H2O+4e-====4OH-
略