分类是化学学习与研究的常用方法,下列分类正确的是( )
A.Na2O、MgO、Al2O3均属于碱性氧化物
B.石灰石、生石灰、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如右图所示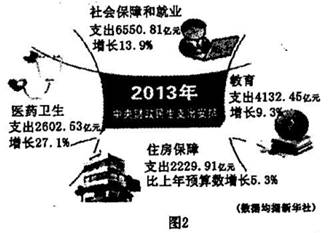
知识点:物质的分类
D
略
高铁酸钾(K2FeO4)是一种新型的自来水处理剂,它的性质和作用是( )
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
知识点:氧化还原反应
A
略
下列有关实验的叙述正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
知识点:仪器和基本操作
D
略
下列应用化学学科研究物质性质的基本方法或所得结论中,不正确的是( )
A.根据物质的元素组成,将纯净物分为单质和化合物
B.通过钠、镁、铝与水反应的实验,比较三种单质的金属性
C.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应
D.打开盛装浓盐酸的试剂瓶塞,观察现象,了解氯化氢的某些物理性质
知识点:仪器和基本操作
C
略
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
知识点:离子共存
B
略
下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是( )
A
B
C
D
试样
Na2CO3(NaHCO3)
Mg(OH)2(Ca(OH)2)
CO2(SO2)
Cl2(HCl)
除杂试剂
澄清石灰水
MgCl2溶液
饱和Na2CO3溶液
NaOH溶液
知识点:物质的分离、除杂和提纯
B
略
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
知识点:化学中常用计量
D
略
下列离子方程式书写正确的是( )
A.氯化亚铁溶液跟过量氯气反应:2 Fe2+ + Cl2 = 2 Fe3+ + 2 Cl -
B. 向碳酸氢钠溶液中滴加少量稀硝酸:CO32 - + 2H + = CO2 + H2O
C.铜与稀硝酸反应:Cu + 4H+ + 2NO3 - = Cu2+ + 2 NO2 + 2H2O
D.碳酸氢铵溶液和足量氢氧化钠溶液反应: NH4+ + OH - = NH3·H2O
知识点:离子方程式
A
略
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内气体的温度和密度相等时,下列说法正确的是( )
A.两种气体的压强相等 B.两种气体的氧原子数目相等
C.两种气体的分子数目相等 D. O2比O3质量小
知识点:阿弗加德罗定律
B
略
将标准状况下2.24LCO2缓慢通入100mL1.5mol·L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是( )
A. c(![]() )>c(
)>c(![]() )
)
B. c(![]() )+c(
)+c(![]() )=1 mol·L-1
)=1 mol·L-1
C.c(![]() )>c(
)>c(![]() )
)
D.c(![]() )+c(
)+c(![]() )=c(
)=c(![]() )+2c(
)+2c(![]() )+c(
)+c(![]() )
)
知识点:盐类水解
D
略
下列解释实验现象的反应方程式正确的是( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2==Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-==Ag2S↓+2Cl-
C.向NaAlO2溶液中通人少量CO2,出现白色沉淀:AlO2-+CO2+2H2O===Al(OH)3↓+ HCO3-
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O[
知识点:离子方程式
B
略
在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.6:7 B.1:1 C.7:6 D.9:4
知识点:钠和碱金属
A
略
用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是( )
A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
知识点:化学式的计算
C
略
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1 ( b – 2a ) mol/L B.10 ( 2a – b ) mol/L
C.10 ( b – a ) mol/L D.10 ( b – 2a ) mol/L
知识点:溶液浓度的计算
D
略
下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是( )(已知常温下NaHCO3的溶解度小于Na2CO3、NaCl、NH4Cl、(NH4)2CO3和NH4HCO3的溶解度)
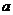
X Y Z
A.NO2 SO2 BaCl2
B.NH3 O2 Al2(SO4)3
C.NH3 CO2 NaCl(饱和)
D.CO O2 Ca(OH)2
知识点:物质的检验和鉴别
D
略
氰化物有剧毒,我国工业废水中氰化物(CN-)的最高允许排放浓度为0.5 mg/L;对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和CO2等,使废水得到净化。发生的反应为:
2CN- + 8OH-+ 5Cl2 = 2CO2 ↑+ N2 ↑+10 Cl-+ 4H2O
下列有关说法正确的是( )
A.上述反应中氧化产物只有N2
B.经测定,NaCN的水溶液呈碱性,说明CN—能促进水的电离
C.若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D.现取1 L含CN-1.04mg/L的废水,至少需用4.0×10-5mol Cl2处理后才符合排放标准
知识点:氧化还原反应
B
略
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。
下列有关说法正确的是( )
A.大量的氮、磷废水排入海洋,易引发赤潮
B.工段②中结晶出的MgCl2· 6H2O可在空气中受热分解制无水MgCl2
C.在工段③④⑤中溴元素均被氧化
D.工段①中除去粗盐中的SO42-、Ca2+ 、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
知识点:物质的分离、除杂和提纯
A
略
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
知识点:物质的检验和鉴别
A
略
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
知识点:镁铝及其化合物
B
略
在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是( )

A.原溶液中n(Mg2+)∶n(Al3+)=5∶2
B. 原溶液的pH=2
C.x与y的差值为0.01 mol
D.原溶液中c(Cl-)=0.75 mol·L-1
知识点:氮族元素
C
略
(8分)试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为 。
(2)把1 molNa和1mol Mg分别投入到两杯体积3L浓度1mol/L的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为![]()
![]() (填“”<、“>”、或“=”)。
(填“”<、“>”、或“=”)。
(3)右图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
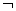
①该浓盐酸中HCl的物质的量浓度为 mol/L。
②标准状况下,1.00L水(密度:1.00g·cm-3)
吸收 L的HCl可制得上述浓盐酸。
知识点:溶液浓度的计算
(8分)
(1)80g/mol(2分) (2)= (2分) (3)① 11.9(2分) ② 353(2分)
略