设NA为阿伏加德罗常数,下列说法正确的是( )
A、标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B、标准状况下,14 g氮气含有的核外电子数为5NA
C、标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D、标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
知识点:物质的量
C
解析: A、标准状况下四氯化碳不是气体,无法计算5.6L四氯化碳的物质的量,故A错误; B、14g氮气的物质的量为0.5mol,含有7mol核外电子,含有的核外电子数为7NA,故B错误; C、标准状况下,气体摩尔体积为22.4L/mol,所以22.4 L任意比的氢气和氯气的混合气体的物质的量为1mol,含有的分子总数均为NA,故C正确;
D、生成1mol氢气,需要得到2mol电子,转移的电子数为2NA,故D错误;
故选:C.本题考查了阿伏伽德罗常数,题目难度不大,注意标准状况下四氯化碳不是气体,熟练掌握物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量间关系.
下列叙述正确的是( )
A、相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B、等物质的量的甲基(﹣CH3)与羟基(﹣OH)所含电子数相等
C、常温常压下28gCO与22.4LO2所含分子数相等
D、16gCH4与18gNH4+所含质子数相等
知识点:物质的量
B
本题考查阿伏加德罗定律及推论.相同条件下,N2和O3的混合气体与等体积的N2的物质的量相同,则分子数相同,但N2和O3的分子组成原子数目不同,则所含原子数不等,故A错误;一个甲基含有的电子数为:6+3=9,一个羟基含有的电子数为:8+1=9,等物质的量时所含电子数相同,故B正确;常温常压下气体的Vm≠22.4L/mol,22.4LO2不等于1mol,常温常压下28gCO与22.4LO2所含分子数不等,故C错误; D、16gCH4的物质的量为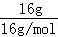 =1mol,含质子的物质的量为10mol,18gNH4+的物质的量为
=1mol,含质子的物质的量为10mol,18gNH4+的物质的量为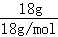 =1mol,含质子的物质的量为11mol,所含质子数不等,故D错误.本题考查阿伏加德罗定律及推论的应用,题目难度中等,注意把握粒子的组成原子的结构特点.
=1mol,含质子的物质的量为11mol,所含质子数不等,故D错误.本题考查阿伏加德罗定律及推论的应用,题目难度中等,注意把握粒子的组成原子的结构特点.
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl﹣离子完全沉淀.反应中消耗xmolH2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol•L﹣1为( )
A.

B.

C.

D.

知识点:物质的量
下列叙述正确的是( )
A.
含1 mol溶质的任何溶液,物质的量浓度一定相等
B.
配制1 mol/L NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中即可
C.
体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同
D.
1 L 0.5 mol/L CaCl2溶液中,Ca2+与Cl﹣的物质的量浓度都是0.5 mol/L
知识点:物质的量
C
解析:因缺少溶液的体积,含1mol溶质的任何溶液,物质的量浓度无法确定,也就无法比较大小,故A错误; 58.5gNaCl溶于1 L水中,所配溶液体积大于1L,溶液浓度不等于1 mol/L,故B错误; 体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数必相同,故C正确; 1L0.5mol/LCaCl2溶液中,Ca2+、Cl﹣物质的量浓度分别为0.5 mol/L,1mol/L,故D错误;
只有一种元素的物质( )
A.
可能是纯净物也可能是混合物
B.
可能是单质也可能是化合物
C.
一定是纯净物
D.
一定是一种单质
知识点:物质的分类
A
解析:由同一种元素组成的纯净物叫做单质,一种元素可构成不同的单质,它们互为同素异形体,如由碳元素形成单质有金刚石和石墨以及无定形的碳.由磷元素形成的单质有红磷和白磷.由氧元素形成的单质有氧气和臭氧.因此含有一种元素的不一定是纯净物,可能是由几种单质混合在一起的混合物.化合物是指由不同元素组成的纯净物,至少有两种元素,所以只含有一种元素一定不是化合物.本题考查了一些基本概念,比较简单,只要理解了基本概念,就能很好的解决这类题目
将下列物质按酸、碱、盐分类顺序排列正确的是( )
A.
硫酸、纯碱、石膏
B.
氢硫酸、烧碱、绿矾
C.
醋酸、乙醇、醋酸钠
D.
磷酸、熟石灰、苛性钾
知识点:物质的分类
B
解析:解:A、硫酸属于酸,纯碱属于盐,石膏属于盐,故A错误; B、氢硫酸属于酸,烧碱属于碱,绿矾属于盐.故B正确; C、醋酸属于酸,乙醇是有机物不是碱,醋酸钠属于盐,故C错误; D、磷酸属于酸,熟石灰属于碱,苛性钾属于碱,故D错误.
故选.本题考查了酸、碱、盐的概念辨析,要充分理解酸碱盐的概念的含义,只有这样才能对各种物质进行正确的分类
下列有关分散系的说法正确的是( )
A.
根据能否发生丁达尔效应将分散系分为浊液、溶液和胶体
B.
在Fe(OH)3胶体中加入过量盐酸不溶解
C.
“血液透析”原理同溶液中固体颗粒的过滤原理相似
D.
除加入电解质可使胶体聚沉外,将两种带相反电荷胶粒的胶体混合也能发生聚沉
知识点:分散系
D
解析: 分散系的分类依据是分散质微粒直径大小,不是根据能否发生丁达尔效应,浊液和溶液都没有丁达尔效应,故A错误; B.Fe(OH)3属于弱碱,能与强酸发生中和反应,所以在Fe(OH)3胶体中加入过量盐酸会生成氯化铁溶液,Fe(OH)3胶体会溶解,故B错误; C.血液属于胶体,“血液透析”采用的是胶体渗析原理,与过滤原理不相似,故C错误; D.除加入电解质可使胶体聚沉外,将胶粒带相反电荷的两种胶体混合也能发生聚沉,
下列各组离子能在pH=1的无色溶液中大量共存的是( )
A.
Ba2+、Na+、I﹣、ClO﹣
B.
Mg2+、Cl﹣、Al3+、SO42﹣
C.
K+、Cl﹣、HCO3﹣、NO3﹣
D.
Ca2+、Na+、Fe3+、AlO2﹣
知识点:离子共存
B
解析: 解:pH=1的溶液中氢离子浓度为0.1mol/L,溶液中存在大量氢离子;无色溶液中可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在, A.I﹣、ClO﹣之间发生氧化还原反应,ClO﹣与溶液中氢离子结合生成弱酸次氯酸,在溶液中不能大量共存,故A错误; B.Mg2+、Cl﹣、Al3+、SO42﹣之间不反应,都不与氢离子反应,且为无色溶液,在溶液中能够大量共存,故B正确; C.HCO3﹣与溶液中氢离子反应生成二氧化碳气体,在溶液中不能大量共存,故C错误; D.Fe3+、AlO2﹣之间发生双水解反应,Fe3+为有色离子,AlO2﹣还能与氢离子反应,在溶液中一定不能大量共存,故D错误;
下列离子方程式书写正确的是( )
A.
氯气跟水反应:Cl2+H2O=2H++Cl﹣+ClO﹣
B.
硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42﹣=BaSO4↓
C.
碳酸钠溶液中加入少量稀盐酸:CO32﹣+H+=HCO3﹣
D.
铜与稀盐酸反应:Cu+2H+=Cu2++H2↑
知识点:离子方程式
C
解析:A.氯气跟水反应,离子方程式:Cl2+H2O=H++Cl﹣+HClO,故A错误;
B.硫酸铜溶液跟氢氧化钡溶液反应,离子方程式:2H++2OH﹣+Ba2++SO42﹣=BaSO4↓+2H2O,故B错误; C.碳酸钠溶液中加入少量稀盐酸,离子方程式:CO32﹣+H+=HCO3﹣,故C正确; D.铜与盐酸不反应,故D错误;本题考查了离子方程式的书写,明确反应的实质是解题关键,注意碳酸根于氢离子反应的过程,为易错点.
下列反应中,SO2作还原剂的是( )
A.
2H2S+SO2→3S↓+2H2O
B.
SO2+2Mg→2MgO+S
C.
Cl2+SO2+2H2O→H2SO4+2HCl
D.
SO2+2NaOH→Na2SO3+H2O
知识点:氧族元素
C
解析:A.该反应中,二氧化硫中硫元素得电子化合价降低,所以二氧化硫是氧化剂,故A错误; B.反应中,S元素化合价降低,被还原,SO2为氧化剂,故B错误; C.S元素化合价升高,被氧化,为还原剂,故C正确; D.S元素化合价不变,不是氧化还原反应,故D错误.本题考查氧化还原反应,侧重于基本概念的理解和运用的考查,为高频考点,注意从元素化合价的角度解答该题,难度不大,注意相关基础知识的积累.
能与大量Fe3+共存的是( )
A.
Fe
B.
S2﹣
C.
Cu2+
D.
Cu
知识点:离子共存
C
解析:A.Fe与Fe3+发生氧化还原反应生成二价铁离子,故A错误; B.Fe3+具有较强的氧化性,S2﹣具有较强的还原性,发生氧化还原反应,不能共存,故B错误; C.Fe3+与Cu2+离子之间不反应,能共存,故C正确; D.Fe3+与Cu发生氧化还原反应,则不能共存,故D错误
把2.1g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A.
7.2g
B.
3.6g
C.
2.1g
D.
无法确定
知识点:钠和碱金属
C
解析:CO在氧气中完全燃烧生成CO2,CO2和再与Na2O2反应,方程式为2CO+O2 2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量,
2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量,
H2在氧气中完全燃烧,生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,
2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,
故由2.1gCO和H2组成的混合物在足量的O2中充分燃烧,立即通入足量的Na2O2固体,固体质量增加应为CO和H2的质量,即为2.1g,
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最少的是( )
A.
Al
B.
Al(OH)3
C.
AlCl3
D.
Al2O3
知识点:镁铝及其化合物
B
解析:A.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1gAl消耗NaOH质量= =1.48g;
=1.48g;
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O,1g氢氧化铝消耗氢氧化钠质量=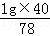 =0.51g;
=0.51g;
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,1g氯化铝消耗氢氧化钠质量=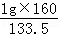 =1.12g;
=1.12g;
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,1g氧化铝消耗氢氧化钠的质量=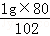 =0.78g,相同质量的Al、Al(OH)3、Al2O3、AlCl3,Al(OH)3消耗NaOH最少,本题考查铝及其化合物的性质、化学方程式有关计算,难度不大,注意基础知识的掌握.
=0.78g,相同质量的Al、Al(OH)3、Al2O3、AlCl3,Al(OH)3消耗NaOH最少,本题考查铝及其化合物的性质、化学方程式有关计算,难度不大,注意基础知识的掌握.
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.
明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的杀菌净化
B.
在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.
MgO的熔点很高,可用于制作耐高温材料
D.
电解MgCl2饱和溶液,可制得金属镁
知识点:镁铝及其化合物
AD
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体 g.
(3)称量.①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的 (填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用 玻璃棒 引流,需要洗涤烧杯2~3次是为了 (6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、 、 .
(8)在配制过程中,某学生观察定容时液面情况如图2所示,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”).
知识点:综合性实验
(1) 500mL容量瓶 、 胶头滴管
(2) 14.6
(3)①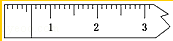
② 左盘
(4) 搅拌,加速NaCl溶解 .
(5) 玻璃棒 保证溶质全部转移入容量瓶中 .
(7) 浓度 、 名称 .
(8) 偏低
解析:(1)操作步骤有计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2﹣3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所用仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管、药匙,尚缺的仪器或用品有:500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管
(2)需要碳酸钠的质量为:m=0.5L×0.5mol•L﹣1×58.5g/mol=14.6g,
故答案为:14.6
(3)①称量时砝码质量为:10g×1+2g×2=14g,游码的质量为0.6g,则游码应该为: ,
,
故答案为:
 ;
;
②使用托盘天平时,药品应该放在左盘,所以氯化钠应该放在托盘天平的左盘,
故答案为:左盘;
(4)溶解的实验中需要使用玻璃棒进行搅拌,加速氯化钠的溶解,
故答案为:搅拌,加速NaCl溶解;
(5)转移溶液时需要使用玻璃棒引流,避免溶液流到容量瓶以外;定容前还应该洗涤烧杯和玻璃棒,目的是将溶质全部转移到容量瓶中,
故答案为:玻璃棒;保证溶质全部转移入容量瓶中;
(7)试剂瓶上需要标注溶液的配制时间、名称和溶液的物质的量浓度,
故答案为:名称;浓度;
(8)在配制过程中,某学生观察定容时液面情况如图2所示,会导致加入的蒸馏水体积偏大,所配溶液的浓度会偏低,故答案为:偏低.
本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.
某化学反应的反应物和产物如下,如果该化学方程式中S和H2SO4的系数分别是5和1
(1)请配平下面的化学方程式:
CuS+ HNO3= Cu(NO3)2+ S+ H2SO4+ NO+ H2O
(2)该反应中,发生氧化反应的物质是 ,发生还原反应的物质是 .
(3)反应中,1mol 还原剂 (选填“得到”或“失去”) mol电子.
(4)如在标准状况下,反应产生336mL气体,则转移的电子数为 个.
知识点:氧化还原反应
(1)6;18;6;5;1;6;8;
(2)CuS;HNO3;
(3)失去;7;
(4)0.045NA.
解析:(1)该反应中S元素化合价由﹣2价变为0价、+6价,N元素化合价由+5价变为+2价,该化学方程式中S和H2SO4的系数分别是5和1,则失电子的个数为18,根据转移电子守恒得NO的计量数为6,结合原子守恒配平方程式为6CuS+18HNO3=6Cu(NO3)2+5S+1H2SO4+6NO+8H2O,
故答案为:6;18;6;5;1;6;8;
(2)该反应中,还原剂CuS发生氧化反应、氧化剂HNO3发生还原反应,故答案为:CuS;HNO3;
(3)该反应中,1mol还原剂CuS失电子的物质的量=1mol×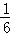 ×[0﹣(﹣2)]+1mol×
×[0﹣(﹣2)]+1mol×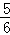 ×[6﹣(﹣2)]=7mol,
×[6﹣(﹣2)]=7mol,
故答案为:失去;7;
(4)标准状况下,反应产生336mL气体,则转移的电子数= ×NA/mol=0.045NA,
×NA/mol=0.045NA,
故答案为:0.045NA.本题考查氧化还原反应配平、计算,明确反应中元素化合价变化是解本题关键,注意该反应中S元素有两种化合价变化,难点是(3)中失电子物质的量的计算,题目难度中等.
A﹣J是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知A是一种高熔点物质,D是一种红棕色固体.

请回答下列问题:
(1)A物质的名称为 ,H与I反应的化学方程式 (2)C与D在高温下的反应在冶金工业上称为 反应,引发该反应的实验操作是 (3)写出G→J的化学方程式:
(4)A→H的离子方程式为
(5)用离子方程式表示I物质能用于净水的原理 .
知识点:无机框图推断
(1)氧化铝;AlCl3+3NaAlO2+6H2O=3NaCl+4Al(OH)3↓;
(2)铝热;镁条引燃;
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)Al2O3+2OH﹣=2AlO2﹣+H2O;
(5)Al3++3H2O=Al(OH)3(胶体)+3H+.
解析:D是一种红棕色固体,应为Fe2O3,由转化关系可知C为Al,A为Al2O3,E为Fe,B为O2,H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,
(1)A为Al2O3,NaAlO2和AlCl3互相促进水解,化学方程式为AlCl3+3NaAlO2+6H2O=3NaCl+4Al(OH)3↓,
故答案为:氧化铝;AlCl3+3NaAlO2+6H2O=3NaCl+4Al(OH)3↓;
(2)C与D在高温下的反应为2Al+Fe2O3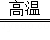 2Fe+Al2O3,在冶金工业上称为铝热反应,使用镁条引燃,故答案为:铝热;镁条引燃;
2Fe+Al2O3,在冶金工业上称为铝热反应,使用镁条引燃,故答案为:铝热;镁条引燃;
(3)G→J是Fe(OH)2被氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)A→H是氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH﹣=2AlO2﹣+H2O,故答案为:Al2O3+2OH﹣=2AlO2﹣+H2O;
(5)I为AlCl3,AlCl3水溶液中铝离子水解Al3++3H2O=Al(OH)3(胶体)+3H+,生成的氢氧化铝胶体具有吸附性,可用于净水,故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+.
本题是一道典型的无机框图推断题,为高考常见题型,侧重于考查对元素化合物基础知识的掌握,还主要考查学科内知识间的综合推理能力,难度中等,突破口为:D物质的颜色,A的分解条件及A能与氢氧化钠溶液、盐酸反应,利用猜测验证法推断,题目难度中等
(2010•中山模拟)将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH
溶液.请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.
当V1=160mL时,则金属粉末中n(Mg)= mol,
V2= mL.
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)= mL.
(3)若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL 2mol/L的硫酸溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3.满足此条件的a的取值范围是: .

知识点:化学计算的综合运用
(1)0.06mol,440 mL;
(2)400ml;
(3)0.5≤a<1.
解析(1)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=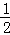 n(NaOH)=
n(NaOH)=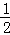 ×0.16L×1mol/L=0.08mol
×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42﹣离子守恒有:x+3y=0.1×2﹣0.08
联立方程,解得:x=0.06、y=0.02
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L+0.04mol=0.44mol,
所以,V2=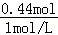 =0.44L=440ml,故答案为:0.06mol,440 mL;
=0.44L=440ml,故答案为:0.06mol,440 mL;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42﹣离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)= =0.4L=400ml
=0.4L=400ml
故答案为:400ml;
(3)由于为金属混合物,则a<1,Al的物质的量为0.1(1﹣a)mol,反应后的混合溶液,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1﹣a)mol,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),即0.45×1≥2×0.1×2+0.1(1﹣a),解得a≥0.5,故0.5≤a<1,
故答案为:0.5≤a<1.
本题以图象形式考查混合物计算,难度中等,清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化