将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4 + 28HNO3 = 9Fe(NO3)x + NO↑ + 14H2O 下列判断合理的是:
A.Fe(NO3)x中的x为2
B.反应中每还原0.2 mol氧化剂,就有0.6 mol电子转移
C.稀HNO3在反应中只表现氧化性
D.磁性氧化铁中的所有铁元素全部被氧化
知识点:氧化还原反应
B
略
氰化物有剧毒,我国工业废水中氰化物(CN-)的排放最高充许浓度为0.5 mg/L。在碱性条件下可用如下方法进行处理:
2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O。下列说法不正确的是:
A.当有0.4 mol CO2生成时,反应中转移电子总数约为2×6.02×1023
B.1 L含CN-0.9 mg/L的废水至少用1.0×10-3 mol Cl2处理才符合排放标准
C.经测定,NaCN的水溶液呈碱性,说明CN-促进了水的电离
D.上述反应中CN-表现了还原性
知识点:化学中常用计量
B
略
(14分)在某无色溶液X里,可能含有下表所列的离子中的某几种。
阳离子
Al3+、NH+ 4、Mg2+、Na+、Fe3+
阴离子
CO2- 3、SiO2- 3、AlO- 2、Cl-
现取适量X,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积的关系如图所示。
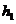
(1)若Y是盐酸,则oa段转化为沉淀的离子是
__________; ab段反应的总的离子方程式是
_______________;bc段发生反应的离子方程式为___________________。
(2)若Y是氢氧化钠溶液,则X中一定含有的阴离子是_______;
ab段反应的离子方程式是_____________;bc段发生反应的离子方程式是______________;产生沉淀的离子的物质的量之比约为______________。
知识点:物质的检验和鉴别
14分
(1)SiO2- 3(1分),AlO- 2(1分) ab:CO2- 3+2H+=CO2↑+H2O(2分)
bc:Al(OH)3+3H+=Al3++3H2O(2分)
(2)Cl-(2分) ab:NH+ 4+OH-=NH3•H2O(2分,其它合理答案也给分)
bc:Al(OH)3+OH-=AlO- 2+2H2O(2分)
n(Mg2+) : n(Al3+)=1 : 2(2分,表述清楚即可给分)
略
(14分)铁是目前应用最广泛的金属。铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则0.54 g该样品中n(Cl-)=______mol,x的值是_______。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.1,则该样品中FeCl3的物质的量分数为_______。
(3)FeCl3与氢碘酸反应的离子方程式为:__________________________________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下加热反应可制取K2FeO4,其反应的离子方程式为:__________________________________________________________;与MnO2-Zn碱性电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作_______极(选填“正”、“负”、“阴”、“阳”),该电池总反应的离子方程式为_______________________________________。
知识点:仪器和基本操作
14分
(1)0.01(2分) 3(2分)
(2)10%或1/10(2分)
(3)2Fe3++2I-=2Fe2++I2(2分)
(4)2Fe3++3ClO-+10OH-=2FeO2- 4+3Cl-+5H2O(2分)
(5)正(2分)
2FeO2- 4+3Zn+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-(2分,其它合理答案也给分)
略
(14分)科学家利用太阳能分解水生成的氢气在催化剂存在的条件下与一氧化碳合成甲醇,并用甲醇制成燃料电池。已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8 kJ/mol、-283.0 kJ/mol、-726.5 kJ/mol。请回答下列问题:
(1)用太阳能分解1 mol 液态H2O消耗的能量是_________kJ。
(2)甲醇CH3OH(l)不完全燃烧生成一氧化碳和液态水的热化学方程式为:
___________________________________________________________。
(3)已知H-H键能为a kJ/mol,形成1 mol H-O释放能量b kJ。则把1 mol O2完全变为2 mol O需要的能量是__________________kJ。
(4)在常温常压下,0.5 mol CO和H2组成的混合气体完全燃烧,放出热量142.62
kJ,则![]() ___________。
___________。
(5)在甲醇-O2酸性燃料电池中,负极电极反应式为_____________;甲醇-O2碱性燃料电池中,负极电极反应式为_____________;理想状态下,该燃料电池工作时,1 mol甲醇可以提供的最大能量为702.1 kJ,则该燃料电池的理论效率是_________。
知识点:电解池
14分
(1)285.8(2分)
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443.5 kJ/mol(2分)
(3)(4b-2a-571.6) (2分)
(4)4 : 1(2分)
(5)CH3OH-6e-+H2O=CO2+6H+(2分)
CH3OH-6e-+8OH-=CO2- 3+6H2O (2分)
96.6%(2分)
略
(16分)钠、硒、铁的化合物均有非常重要的用途。过氧化钠、氯化铁、二氧化硒(SeO2)都是常用到的强氧化剂。其中二氧化硒被还原后生成的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成二氧化硒以回收硒。回答下列问题:
(1)将过氧化钠固体放出氯化亚铁溶液中,如果没有气体生成,有红褐色沉淀,所得溶液为棕黄色。写出该反应的离子方程式:_____________________。
(2)纯净的硝酸亚铁固体受热分解:Fe(NO3)2→Fe2O3+NO2↑+O2↑。则生成的气体中,n(NO2):n(O2)=__________(不考虑N2O4的生成)。
(3)假如硒和浓硝酸反应,产物全是氧化物。还原产物是等物质的量的NO和NO2。写出该反应的化学方程式:________________________________________________。
(4)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O=Se+2SO2- 4+4H+
则SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是_________________。
(5)测定回收得到的SeO2的含量,可以通过下面的方法:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3=2NaI+Na2S2O6
配平方程式①,并用单线桥标明电子转移方向与数目
(6)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL则所测定的样品中SeO2的百分含量为___________。
知识点:综合性实验
16分
(1)3Na2O2+6Fe2++6H2O=6Na++2Fe3++4Fe(OH)3↓(2分)
(2)8 : 1(2分)
(3)Se+2HNO3(浓)=SeO2+NO↑+NO2↑+H2O(2分,其它合理答案也给分)
(4)浓H2SO4>SeO2>SO2(2分)
(5)![]() (4分。其中配平2分,电子转移方向1分,数目1分)
(4分。其中配平2分,电子转移方向1分,数目1分)
(6)93.3%(4分)
略