下列物质属于碱的是( )
A.KCl B.Cu2(OH)2CO3 C.Na2CO3 D.NaOH
知识点:物质的分类
D
【考点】酸、碱、盐、氧化物的概念及其相互联系.
【分析】电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子和酸根离子组成的化合物属于盐.
【解答】解:A.KCl属于盐,故A错误;
B.Cu2(OH)2CO3属于碱式盐,故B错误;
C.Na2CO3属于盐,故C错误;
D.NaOH符合碱的组成,水溶液中电离出的阴离子全部是氢氧根离子,化合物为碱,故D正确;
故选D.
下列仪器适合用于萃取分液的是( )
A. B.
B. C.
C. D.
D.
知识点:仪器和基本操作
B
【考点】物质的分离、提纯的基本方法选择与应用.
【分析】A.图中为圆底烧瓶;
B.图中为分液漏斗;
C.图中为容量瓶;
D.图中为漏斗.
【解答】解:A.圆底烧瓶可作反应容器或蒸馏实验,蒸馏分离互溶但沸点不同的液体混合物,故A不选;
B.分液漏斗可用于萃取、分液实验,分离因溶解性在不同溶剂中差异大的液体混合物或分层液体,故B选;
C.容量瓶只能用于配制一定浓度的溶液,故C不选;
D.漏斗可分离不溶性固体与溶液,故D不选;
故选B.
下列属于电解质的是( )
A.盐酸 B.蔗糖 C.硫酸铜 D.漂白粉
知识点:弱电解质的电离
C
【考点】电解质与非电解质.
【分析】在水溶液里或熔融状态下能导电的化合物是电解质,电解质首先必须是化合物,水溶液中和熔融状态下都不导电的化合物为非电解质,根据定义分析解答.
【解答】解:A.盐酸是氯化氢气体的水溶液,为混合物不属于电解质和非电解质,故A错误;
B.蔗糖水溶液和熔融状态都不导电,属于非电解质,故B错误;
C.硫酸铜固体水溶液中完全电离出阴阳离子,溶液能导电硫酸铜为强电解质,故C正确;
D.漂白粉是氯化钙和次氯酸钙,属于混合物不是非电解质或电解质,故D错误.
故选C.
下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料.
A.①② B.②③ C.①④ D.③④
知识点:碳族元素
C
【考点】硅和二氧化硅;无机非金属材料.
【分析】根据水晶是二氧化硅,不是硅酸盐,排除A和B;再根据光导纤维的主要成分是二氧化硅可排除D,然后快速选出答案.
【解答】解:①几乎所有的岩石和矿物都含有硅酸盐或者二氧化硅,则硅是构成一些岩石和矿物的基本元素,故①正确;
②水泥、玻璃是硅酸盐产品,水晶的主要成分是二氧化硅,故②错误;
③光导纤维的主要成分是二氧化硅,故③错误;
④陶瓷的主要原料是黏土,则陶瓷是人类应用很早的硅酸盐材料,故④正确;
故选:C.
下列对化学知识概括合理的是( )
A.酸性氧化物都是非金属氧化物
B.乙醇和二甲醚分子式相同,结构不同,互为同素异形体
C.丁达尔效应可用于区别溶液与胶体
D.熔融状态能导电的物质一定是离子化合物
知识点:基本概念、基本理论的综合运用
C
【考点】物质的检验和鉴别的基本方法选择及应用;离子化合物的结构特征与性质.
【分析】A.酸性氧化物可能为金属氧化物;
B.分子式相同,结构不同的有机物互为同分异构体;
C.丁达尔现象为胶体特有的性质;
D.熔融状态能导电的物质可能含自由电子或自由离子.
【解答】解:A.酸性氧化物可能为金属氧化物,如Mn2O7为酸性氧化物,故A错误;
B.分子式相同,结构不同的有机物互为同分异构体,则乙醇和二甲醚互为同分异构体,故B错误;
C.丁达尔现象为胶体特有的性质,则丁达尔效应可用于区别溶液与胶体,故C正确;
D.熔融状态能导电的物质可能含自由电子或自由离子,则熔融状态能导电的物质可能为金属单质或离子化合物,故D错误;
故选C.
下列说法不正确的是( )
A.重氢、超重氢是制造氢弹的原料
B.氯气可用于农药生产、药物合成
C.钠钾合金可用于中子反应堆作热交换剂
D.碳酸钡可用作检查肠胃的内服药剂
知识点:化学与科学
D
【考点】物质的组成、结构和性质的关系.
【分析】A.重氢和超重氢两种核素都可用做制造氢弹的原料;
B.Cl元素可用于制备农药;
C.依据钠钾合金具有良好的导热性解答;
D.碳酸钡易溶液盐酸,二者反应生成氯化钡和水,钡离子为重金属离子,引起重金属离子中毒.
【解答】解:A.重氢、超重氢是制造氢弹的原料,故A正确;
B.氯气是一种重要的化工原料,可制备HCl等,可用于农药的生产等,如制备农药六六六等,故B正确;
C.钠钾合金具有良好的导热性,可用于中子反应堆作热交换剂,故C正确;
D.碳酸钡用作检查肠胃的内服药剂,容易引起重金属离子中毒,故D错误;
故选:D.
下列说法正确的是( )
A.一个D2O分子所含的中子数为8
B.CO2的电子式:
C.水的结构简式:H﹣O﹣H
D.HCl的电子式:
知识点:化学用语
C
【考点】电子式、化学式或化学符号及名称的综合.
【分析】A.D2O分子中D含有1个中子,O含有8个中子;
B.二氧化碳中C与O之间存在2个电子对;
C.水中存在O﹣H键;
D.HCl为共价化合物.
【解答】解:A.D2O分子中D含有1个中子,O含有8个中子,一个D2O分子所含的中子数为10,故A错误;
B.二氧化碳中C与O之间存在2个电子对,电子式为 ,故B错误;
,故B错误;
C.水中存在O﹣H键,结构式为H﹣O﹣H,故C正确;
D.HCl为共价化合物,电子式为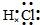 ,故D错误.
,故D错误.
故选C.
下列关于碳酸钠和碳酸氢钠的叙述,正确的是( )
A.常温时,在水中的溶解性:碳酸钠>碳酸氢钠
B.热稳定性:碳酸钠<碳酸氢钠
C.质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠
D.物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠
知识点:钠和碱金属
A
【考点】钠的重要化合物.
【分析】A.依据碳酸钠水溶性大于碳酸氢钠解答;
B.碳酸氢钠不稳定受热分解生成碳酸钠;
C.碳酸钠与盐酸反应先转化为碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳;
D.依据碳原子个数守恒解答.
【解答】解:A.常温时,在水中的溶解性:碳酸钠>碳酸氢钠,故A正确;
B.碳酸氢钠加热发生分解反应2NaHCO3 Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故B错误;
Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故B错误;
C.碳酸钠与盐酸反应先转化为碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳,故相同条件下,与酸反应的速率碳酸钠<碳酸氢钠,故C错误;
D.物质的量相同时,碳酸钠和碳酸氢钠含有碳原子数相同,与足量盐酸反应生成二氧化碳的量相同,故D错误;
故选:A.
下列说法正确的是( )
A.FeCl3溶液需存放在加有少量铁粉的试剂瓶中,防止变质
B.食盐水中Ca2+、SO42﹣等杂质的去除,应先加Na2CO3溶液,后加BaCl2溶液
C.用四氯化碳来萃取碘水中的I2,有机层应从分液漏斗的下端放出
D.用BaCl2溶液来检验暴露在空气中的Na2SO3样品是否变质
知识点:仪器和基本操作
C
【考点】铁盐和亚铁盐的相互转变;物质的分离、提纯和除杂;物质的检验和鉴别的基本方法选择及应用.
【分析】A.氯化铁溶液和铁反应生成氯化亚铁;
B.SO42﹣、Ca2+离子分别转化为硫酸钡、碳酸钙、沉淀而除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的盐酸溶液;
C.四氯化碳不溶于水比水重,且碘易溶于四氯化碳;
D.亚硫酸钠和硫酸钠与氯化钡溶液都发生反应生成白色沉淀.
【解答】解:A.氯化铁溶液和铁反应生成氯化亚铁,不能防止氯化铁变质,应是氯化亚铁中加入铁粉防止变质,故A错误;
B.SO42﹣、Ca2+等分别与BaCl2溶液、Na2CO3溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液,所以应先加BaCl2溶液再加Na2CO3溶液,故B错误;
C.四氯化碳不溶于水且比水重,且碘易溶于四氯化碳,可用四氯化碳萃取碘水中的碘,有机层应从分液漏斗的下端放出,故C正确;
D.亚硫酸钠和硫酸钠与氯化钡溶液都发生反应生成白色沉淀,不能用BaCl2溶液来检验暴露在空气中的Na2SO3样品是否变质,应再加入盐酸进行检验,故D错误;
故选C.
 呼气法在医学上常用于门螺旋杆菌的诊断,下列关于
呼气法在医学上常用于门螺旋杆菌的诊断,下列关于 的说法中正确的是( )
的说法中正确的是( )
A.质子数是6 B.质量数是6 C.电子数是13 D.中子数是13
知识点:元素周期律与元素周期表
A
【考点】质量数与质子数、中子数之间的相互关系.
【分析】元素符号左下角数字为其质子数,左上角数字为其质量数,中子数=质量数﹣质子数,核外电子数=质子数.
【解答】解: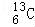 的质子数为6,质量数为13,核外电子数6,由质量数=质子数+中子数可知,中子数为14﹣6=8,故选A.
的质子数为6,质量数为13,核外电子数6,由质量数=质子数+中子数可知,中子数为14﹣6=8,故选A.
有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
A.2:1 B.1:1 C.1:2 D.4:2
知识点:化学式的计算
B
【考点】化学方程式的有关计算.
【分析】两个过程最终多都得到NaCl,由钠离子守恒可知得到NaCl相等,由氯离子守恒可知消耗HCl相等.
【解答】解:两个过程最终多都得到NaCl,由钠离子守恒可知,两过程得到NaCl物质的量相等,由氯离子守恒可知两过程消耗HCl的质量相等,故选:B.
如图所示为实验中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的是( )
实验室制氧
用石灰石和稀盐酸制取
CO2
蒸馏
溶液转移




A
B
C
D
知识点:仪器和基本操作
B
【考点】化学实验方案的评价.
【分析】A.浓盐酸与二氧化锰反应需要加热;
B.为固液反应,且关闭止水夹可使固体与液体分离;
C.蒸馏时温度计测定馏分的温度,冷却水下进上出;
D.转移液体应引流.
【解答】解:A.图中缺少酒精灯加热,不能生成氯气,故A错误;
B.石灰石与盐酸反应生成二氧化碳,止水夹可控制反应的停止,图中装置可制备气体,故B正确;
C.图中温度计的水银球应在支管口处,冷凝管中水应下进上出,故C错误;
D.图中缺少玻璃棒,故D错误;
故选B
下列离子方程式书写正确的是( )
A.向FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl﹣
B.Ba(OH)2溶液与硫酸反应:OH﹣+H+═H2O
C.次氯酸钙溶液中通入少量SO2:2ClO﹣+Ca2++SO2+H2O═CaSO3↓+2HClO
D.碳酸氢钠溶液中加入过量石灰水:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O
知识点:离子方程式
D
【考点】离子方程式的书写.
【分析】A.电子、电荷不守恒;
B.漏写生成硫酸钡的离子反应;
C.发生氧化还原反应生成硫酸钙;
D.碳酸氢钠完全反应,生成碳酸钙、水、NaOH.
【解答】解:A.向FeCl2溶液中通入Cl2的离子反应为2Fe2++Cl2═2Fe3++2Cl﹣,故A错误;
B.Ba(OH)2溶液与硫酸反应的离子反应为SO42﹣+Ba2++2OH﹣+2H+═2H2O+BaSO4↓,故B错误;
C.次氯酸钙溶液中通入少量SO2的离子反应为2ClO﹣+Ca2++SO2+H2O═CaSO4↓+Cl﹣+H++HClO,故C错误;
D.碳酸氢钠溶液中加入过量石灰水的离子反应为HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O,故D正确;
故选D.
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下列判断正确的是( )
甲
乙
丙
丁
戊
A.原子半径:丙<丁<戊
B.金属性:甲>乙
C.最外层电子数:甲>乙
D.最高价氧化物的水化物的碱性:丙>丁>戊
知识点:元素周期律与元素周期表
BD
【考点】位置结构性质的相互关系应用.
【分析】由短周期金属元素甲~戊在元素周期表中的相对位置可知,甲为Li,乙为Be,丙为Na,丁为Mg,戊为Al,
A.同周期从左向右原子半径减小;
B.同周期从左向右金属性减弱;
C.同周期从左向右最外层电子数增多;
D.同周期从左向右金属性减弱,金属性越强,对应最高价氧化物的水化物的碱性越强.
【解答】解:A.同周期从左向右原子半径减小,则原子半径:丙>丁>戊,故A错误;
B.同周期从左向右金属性减弱,则金属性:甲>乙,故B正确;
C.同周期从左向右最外层电子数增多,则最外层电子数:甲<乙,故C错误;
D.金属性丙>丁>戊,对应最高价氧化物的水化物的碱性为丙>丁>戊,故D正确;
故选BD.
把钠放入滴有石蕊试液的水中,下列现象不存在的是( )
A.钠浮在水面上
B.会听到嘶嘶声
C.水溶液变为红色
D.钠熔化成小球,并在水面迅速游动
知识点:钠和碱金属
C
【考点】钠的化学性质.
【分析】钠放入滴有石蕊试液的水中,钠与水反应生成氢氧化钠和氢气,结合钠的物理性质解答.
【解答】解:钠的密度小于水,熔点低,钠与水反应生成氢氧化钠和氢气,所以把钠放入滴有石蕊试液的水中,看到的现象:钠浮在水面上,熔成小球,到处游动,发出嘶嘶的响声,
故选:C.
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:2 B.1:4 C.2:1 D.4:1
知识点:氧化还原反应
A
【考点】氧化还原反应.
【分析】先根据氧化还原反应中得失电子相等配平方程式,再根据化合价变化的和化合价不变的氮原子判断.
【解答】解:该反应中,NH4+→N2氮元素的化合价由﹣3价→0价,生成一个氮气分子需要铵根离子失去6个电子,生成一个二氧化硫分子需要硫酸根离子得到2个电子,所以其最小公倍数是6,然后其它元素根据原子守恒进行配平方程式,所以该方程式为3(NH4)2SO4 3SO2↑+N2↑+4NH3↑+6H2O,该方程式中铵根离子和氨气分子中氮原子的化合价都是﹣3价,化合价不变,所以该反应中化合价发生变化和未发生变化的N原子数之比为1×2:4×1=1:2,
3SO2↑+N2↑+4NH3↑+6H2O,该方程式中铵根离子和氨气分子中氮原子的化合价都是﹣3价,化合价不变,所以该反应中化合价发生变化和未发生变化的N原子数之比为1×2:4×1=1:2,
故选A.
能实现下列物质间直接转化的元素是( )
单质 氧化物
氧化物 酸或碱
酸或碱 盐.
盐.
A.硅 B.硫 C.铜 D.铁
知识点:元素及其化合物的综合运用
B
【考点】硅和二氧化硅.
【分析】A、硅与氧气生成二氧化硅,不溶于水;
B、硫燃烧生成二氧化硫,溶于水形成亚硫酸,可以和碱反应;
C、金属铜和氧气反应生成氧化铜,氧化铜不溶于水;
D、金属铁和氧气反应生成四氧化三铁,不溶于水.
【解答】解:A、硅与氧气生成二氧化硅,不溶于水,所以不能实现下列物质间直接转化,故A错误;
B、S SO2
SO2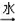 H2SO3
H2SO3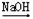 Na2SO3,能实现物质间直接转化,故B正确;
Na2SO3,能实现物质间直接转化,故B正确;
C、金属铜和氧气反应生成氧化铜,氧化铜不溶于水,所以不能实现下列物质间直接转化,故C错误;
D、金属铁和氧气反应生成四氧化三铁,不溶于水,所以不能实现下列物质间直接转化,故D错误;
故选B.
将按等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,再滴入含有品红和Ba(NO3)2的混合溶液,则发生的实验现象是( )
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
A.仅①和④ B.仅①和③ C.仅②和③ D.仅②和④
知识点:氧族元素
C
【考点】二氧化硫的化学性质;氯气的化学性质.
【分析】等物质的量的SO2和Cl2混合后通入含有品红中,发生SO2+Cl2+2H2O=SO42﹣+2Cl﹣+4H+,品红不褪色;通入Ba(NO3)2的混合溶液中,生成硫酸钡沉淀,以此来解答.
【解答】解:等物质的量的SO2和Cl2混合后通入含有品红中,发生SO2+Cl2+2H2O=SO42﹣+2Cl﹣+4H+,品红不褪色;通入Ba(NO3)2的混合溶液中,发生SO2+Cl2+2H2O=SO42﹣+2Cl﹣+4H+、SO42﹣+Ba2+=BaSO4↓,观察到生成白色沉淀,故选C.
向25mL18.4mol/LH2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.小于0.23mol B.等于0.23mol
C.0.23mol~0.46mol之间 D.等于0.46mol
知识点:氧族元素
A
【考点】氧化还原反应的计算.
【分析】n(H2SO4)=0.025L×18.4mol/L=0.46mol,发生Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,稀硫酸与铜不反应,以此解答.
CuSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,稀硫酸与铜不反应,以此解答.
【解答】解:18.4mol•L﹣1H2SO4溶液中加入足量的铜片并加热发生Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
n(H2SO4)=0.025L×18.4mol/L=0.46mol,
随着反应的进行,硫酸浓度逐渐降低,稀硫酸与铜不反应,
则被还原的H2SO4的物质的量小于0.23 mol,
故选A.
某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO3﹣的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1:3 B.4:3 C.2:1 D.3:1
知识点:氧化还原反应
B
【考点】氧化还原反应的计算.
【分析】Cl2生成ClO﹣与ClO3﹣是被氧化的过程,Cl2生成KCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO﹣与ClO3﹣的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比.
【解答】解:Cl2生成ClO﹣与ClO3﹣是被氧化的过程,化合价分别由0价升高为+1价和+5价,
ClO﹣与ClO3﹣的物质的量浓度之比为11:1,
则可设ClO﹣为11mol,ClO3﹣为1mol,被氧化的Cl共为12mol,
失去电子的总物质的量为11mol×(1﹣0)+1mol×(5﹣0)=16mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为﹣1价,
则得到电子的物质的量也应为16mol,
则被还原的Cl的物质的量为16mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为16mol:12mol=4:3,
故选B.
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2═2FeCl3+4FeI3
B.Cl2+FeI2═FeCl2+I2
C.Co2O3+6HCl═2CoCl2+Cl2↑+3H2O
D.2Fe3++2I﹣═2Fe2++I2
知识点:氧化还原反应
A
【考点】氧化性、还原性强弱的比较.
【分析】在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断.
【解答】解:Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,
A、因为氧化性FeCl3>I2,所以氯气先氧化碘离子后氧化亚铁离子,故A错误;
B、因为氧化性FeCl3>I2,所以氯气先氧化碘离子后氧化铁离子,故B正确;
C、因为氧化性Co2O3>Cl2,所以Co2O3+6HCl=2CoCl2+Cl2↑+3H2O能发生,故C正确;
D、因为氧化性FeCl3>I2,所以2Fe3++2I﹣=2Fe2++I2能发生,故D正确;
故选A.
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,22.4L H2中所含质子数、中子数均为2NA
B.32g O2气体和32g O3气体的分子数之比为3:2
C.1L 1mol•L﹣1的盐酸中所含粒子总数为2NA
D.71g氯气与足量铁粉充分反应,转移的电子数为3NA
知识点:物质的量的计算
B
【考点】阿伏加德罗常数.
【分析】A.H2不含中子;
B.依据n=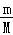 =
=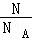 计算解答;
计算解答;
C.粒子种类指代不明确;
D.氯气与铁反应生成氯化铁,氯气不足,依据氯气的物质的量计算转移电子数目.
【解答】解:A.H2不含中子,故A错误;
B.依据n=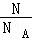 可知分子数之比等于物质的量之比,32g O2气体和32g O3气体的物质的量之比为:
可知分子数之比等于物质的量之比,32g O2气体和32g O3气体的物质的量之比为: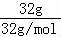 :
: =3:2,故B正确;
=3:2,故B正确;
C.使用物质的量应指明微粒的种类,故C错误;
D.71g氯气的物质的量为1mol,而氯气反应后变为﹣1价,故1mol氯气转移2mol电子即2NA个,故D错误;
故选:B.
实现下列变化时,需克服相同类型作用力的是( )
A.水晶和干冰的熔化 B.食盐和冰醋酸熔化
C.液溴和金刚石的气化 D.纯碱和烧碱的熔化
知识点:化学键
D
【考点】不同晶体的结构微粒及微粒间作用力的区别.
【分析】分子晶体中存在分子间作用力,离子晶体中存在离子键,原子晶体中存在共价键,金属晶体中存在金属键,根据晶体类型分析解答.
【解答】解:A、水晶是原子晶体和干冰是分子晶体,两者熔化时分别克服共价键和分子作用力,故A错误;
B、食盐是离子晶体和冰醋酸是分子晶体,两者熔化时分别克服离子键和分子作用力,故B错误;
C、液溴是分子晶体和金刚石是原子晶体,两者气化时分别克服分子作用力和共价键,故C错误;
D、纯碱和烧碱都是离子晶体,熔化时都克服离子键,故D正确;
故选D.
100mL 2.0 mol•L﹣1 的碳酸钠溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,最终都有气体产生,但生成的气体体积不同,下列选项中盐酸的浓度合理的是( )
A.2.0 mol•L﹣1 B.1.5 mol•L﹣1 C.1 mol•L﹣1 D.0.5 mol•L﹣1
知识点:溶液浓度的计算
B
【考点】化学方程式的有关计算.
【分析】当碳酸钠滴入盐酸中时发生CO32﹣+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,发生反应为CO32﹣+H+═HCO3﹣、HCO3﹣+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,根据二者之间的关系式来分析解答.
【解答】解:当碳酸钠滴入盐酸中时发生CO32﹣+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,反应顺序为CO32﹣+H+═HCO3﹣、HCO3﹣+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,
所以1<n(HCl):n(Na2CO3)<2,n(Na2CO3)=2.0mol/L×0.1L=0.20mol,则0.2mol<n(HCl)<0.4mol,
盐酸的体积是200mL,所以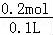 <c(HCl)<
<c(HCl)<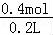 ,
,
即1mol/L<c(HCl)<2mol/L,
故选B.
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH﹣、Cl﹣、HCO3﹣、SO42﹣中的不同阳离子和阴离子各一种组成.已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol•L﹣1乙溶液中c(H+)>0.1mol•L﹣1;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.下列结论不正确的是( )
A.甲溶液含有OH﹣ B.乙溶液含有SO42﹣
C.丙溶液含有Cl﹣ D.丁溶液含有Mg2+
知识点:离子共存
D
【考点】常见离子的检验方法.
【分析】①将甲溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,则甲只能是Ba(OH)2;
②0.1mol/L乙溶液中c(H+)>0.1mol/L,说明乙是硫酸;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,则丁是NH4HCO3,以此来解答.
【解答】解:由②中的信息可知乙是二元酸,故乙是H2SO4;由③中现象,可以推知丙中含有Cl﹣;再结合①中提供信息,甲与其它三种物质混合均产生白色沉淀,
则可推出:甲是Ba(OH)2,乙是H2SO4,丙是MgCl2,丁是NH4HCO3,
A.甲是Ba(OH)2,则碱溶液中含有OH﹣离子,故A正确;
B.乙是H2SO4,则乙溶液中含有氢离子,故B正确;
C.丙是MgCl2,丙溶液含有Cl﹣,故C正确;
D.丁是NH4HCO3,则丁中不含有Mg2+,故D错误;
故选D.