生活中的问题常涉及到化学知识,下列叙述中正确的是:
A.硫酸钡是一种难溶于水和酸的盐,可用作X光透视肠胃的药剂
B.使用明矾可以对水进行消毒、杀菌
C.铁制品在干燥的空气中易生锈
D.棉花、蚕丝和人造丝的主要成分是纤维素
知识点:化学
A
试题分析:A项,硫酸钡难溶于水、也不溶于硫酸和盐酸,在人体以硫酸钡固体形式存在,对人体无毒,钡属于重金属元素,钡以钡离子形式存在会对人体造成伤害,所以可以用硫酸钡做X光透视肠胃的药剂,故A项正确;B项,明矾水解生成氢氧化铝胶体,能吸附色素和固体颗粒,但是不能消毒、杀菌,故B项错误;C项,铁生锈是铁与氧气和水的共同作用下发生缓慢氧化的过程,干燥空气水分少,铁不容易生锈,故C项错误;D项,棉花、人造丝的主要成分是纤维素、蚕丝主要成分是蛋白质,故D项错误。综上所述,本题正确答案为A。
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。
a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是:
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
知识点:化学
B
试题分析:原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1,a-的电子层结构与氦相同,则a为H元素;b和c的次外层有8个电子,原子只能有3个电子层,则b为S元素,c为Cl,c-和d+的电子层结构相同,则d为K元素.A.同周期自左而右非金属性增强,氢化物中H元素为正价,其非金属性最弱,故非金属性Cl>S>H,故A正确;B.H元素与S元素、Cl元素放出形成H2S、HCl,二者属于共价化合物,但与K元素形成的化合物为KH,属于离子化合物,故B错误;C.K元素与其它元素可以形成KH、K2S、KCl,均属于离子化合物,故 C正确;D.H元素最高正化合价为+1、最低负化合价为-1,S元素最高正化合价为+6、最低负化合价为-2,Cl元素最高正化合价为+7、最低负化合价为-1,最高和最低化合价的代数和分别为0、4、6,故D正确,
C正确;D.H元素最高正化合价为+1、最低负化合价为-1,S元素最高正化合价为+6、最低负化合价为-2,Cl元素最高正化合价为+7、最低负化合价为-1,最高和最低化合价的代数和分别为0、4、6,故D正确,
NA代表阿伏加德罗常数的值,下列叙述正确的是:
A.44g丙醇中存在的共价键总数为20NA
B.18gD2O和18gH2O中含有的质子数均为10NA
C.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA
D.235g核素 U发生裂变反应:
U发生裂变反应: U+
U+ n
n
 Sr+
Sr+ U+10
U+10 n,净产生的中子(
n,净产生的中子( n)数为10NA
n)数为10NA
知识点:化学
C

香叶醇是合成玫瑰香油的主要原料,其结构简式如下:

下列有关香叶醇的叙述正确的是:
A.香叶醇的分子式为C10H18O B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色 D.能发生加成反应不能发生取代反应
知识点:化学
A
试题分析:A.由香叶醇的结构简式示意图可知其分子式为C 10H 18O,正确;B.香叶醇分子中含有双键,所以能使溴的四氯化碳溶液褪色,错误;C.香叶醇分子中含有双键和醇羟基,因此能使酸性高锰酸钾溶液褪色,错误;D.香叶醇分子中含有双键,能发生加成反应,含有羟基和饱和C原子,也可以发生取代反应,错误。
下列图像中的曲线,其中错误的是

A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
知识点:化学
C

NH3是一种重要的化工原料,可以 制备一系列物质(见图)。下列说法正确的是
制备一系列物质(见图)。下列说法正确的是


A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件 下可发生氧化还原反应
下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
知识点:化学
C
试题分析:NaHCO3不是常用的化肥,选项A错误;Na2CO3受热时不易分解,选项B错误;8NH3+6NO2===7N2+12H2O,选项C正确;碳酸氢钠受热分解的反应不是氧化还原反应,选项D错误。
利用右图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实 验结论
验结论

A
稀硫酸
Na2SO3
Na2SiO3溶液
非金属性:S>Si
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
B a(NO3
a(NO3 )2溶液
)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
知识点:化学
B
试题分析:A、①②发生反应,产生的H2S在试管中与③中的遇AgNO3与AgCl的溶液,与Ag+结合生成Ag2S沉淀,这与Ksp(AgCl)和Ksp(Ag2S)的大小无关,错误;B、浓硫酸有脱水性,能够使蔗糖脱水碳化。然后浓硫酸与C单质的反应,生成CO2和SO2,在试管中与溴水反应氧化还原反应得到硫酸和氢溴酸。因此证明了浓硫酸具有脱水性、氧化性,正确;C、SO2溶解在试管中使溶液显酸性,这时就与Ba(NO3)2溶液发生氧化还原反应得到SO42-,再发生离子反应得到硫酸钡白色沉淀。若在③中无氧化性的物质存在,则不能发生沉淀反应。错误;D、浓硝酸有挥发性,挥发出的硝酸也会与Na2SiO3溶液反应得到硅酸沉淀。因此不能证明酸性:硝酸>碳酸>硅酸。错误。
(14分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
…
E
A
B
C
…
D
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的 pH=7,则a b(填“>"或“<”或“=”)
pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则在相同条件下,溶解度较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
。
(6)已知一定 量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g)
量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式
与E(s)反应生成EB(g)的热化学方程式
。


(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为
。
知识点:化学
(1)NH3·H2O NH4+ + OH-
NH4+ + OH-
(2)> (3)Al(OH)3(4) ①③
(5)Na3N + 4H2O=3NaOH + NH3·H2O
(6)CO2(g) + C(s) = 2CO(g) ;△H= +172.5kJ/mol
(7)Fe3++e-→Fe2+
试题分析:由题意可得A、B、C、D、E、F分别为N、O、Na、Cl、C、Fe;
(1)A元素的氢化物是NH3,氨水是弱碱,NH3·H2O NH4+ + OH-;
NH4+ + OH-;
(2)同温同压下,将a L NH3气体和b L HCl气体通入水中,生成氯化铵,强酸弱碱盐,溶液呈酸性,若所得溶液的pH=7,则氨气要过量,a>b;
(3)常温下,相同浓度(设浓度均为c)Al3+、Fe3+的溶液中滴加NaOH溶液,Al(OH)3完全沉淀的pH是4.7,其Ksp=C.c3(OH-)=(10-9.3)3 c,Fe(OH)3完全沉淀的pH是2.8,其Ksp= c.c3(OH-)=(10-11.2)3.c ,则Ksp较大的是Al(OH)3;
(4)A与B组成质量比为7:16的三原子分子是NO2,易溶于水,释放在空气中可能引发酸雨和光化学烟雾;而温室效应是因为二氧化碳的排放,臭氧层破坏是氟利昂等造成的;
(5)N和Na组成的离子化合物是Na3N,能与水反应生成两种碱,化学方程式为Na3N + 4H2O=3NaOH + NH3·H2O;
(6)根据能量图,①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
②CO(g)+1/2 O2(g)=CO2(g) △H2=-283.0 kJ/mol
由①-2②得:CO2(g) + C(s) = 2CO(g) △H= +172.5 kJ/mol
+ C(s) = 2CO(g) △H= +172.5 kJ/mol
(7)在Cl与Fe组 成的化合物溶液中,加入铜片,溶液会慢慢变为蓝色,则甲是FeCl3溶液,原电池中石墨作正极,溶液中的Fe3+得电子,电极反应式为Fe3++e-=Fe2+。
成的化合物溶液中,加入铜片,溶液会慢慢变为蓝色,则甲是FeCl3溶液,原电池中石墨作正极,溶液中的Fe3+得电子,电极反应式为Fe3++e-=Fe2+。
(14分)某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释。
(2)组装仪器按气流方向正确的连接顺序是a接____,____接____,____接____。
(3)烧杯中倒置漏斗的作用是____________________________________________。
(4)往FeCl3溶液中通入足量SO2时,观察到的现象为_______________________。
(5)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:____________________________________;
②请设计实验方案检验有Fe2+生成:__________________________________________;
③该小组同学向盛装FeCl3试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法不合理,理由是________________________。
知识点:化学
(1)浓盐酸 (2)d e—c b—f (3)防止溶液倒吸
(4)溶液由棕黄色变成浅绿色
(5)①2Fe3+ + SO2 + 2H2O = SO42- + 4H+ + 2Fe2+
②取FeCl3反应后溶液,滴入KSCN,不变红,再滴入新制的氯水,溶液变红,说明反应有Fe2+离子生成。
③因为硝酸具有强氧化性, 可以把溶解在溶液内的SO2氧化成SO42-,从而干扰离子检验。
可以把溶解在溶液内的SO2氧化成SO42-,从而干扰离子检验。
试题分析:(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是抑制铁离子水解,因此,本题正确答案是:浓盐酸;
(2)根据实验目的,先是制备二氧化硫,用第 一个装置,用最后一个装置,导管要短进长出,可以防止倒吸,然后是让二氧化硫和氯化铁之间反应,即第三个装置,最后进行尾气处理,顺序是:d、e、c、b、f,因此,本题正确答案是:d;e;c;b;f;
一个装置,用最后一个装置,导管要短进长出,可以防止倒吸,然后是让二氧化硫和氯化铁之间反应,即第三个装置,最后进行尾气处理,顺序是:d、e、c、b、f,因此,本题正确答案是:d;e;c;b;f;
(3)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸,因此,本题正确答案是:使气体充分吸收,防止溶液倒吸;
(4)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色,因此,本题正确答案是:溶液由棕黄色变为浅绿色;
(5)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3+ + SO2 + 2H2O = SO42- + 4H+ + 2Fe2+ ;②检验有Fe2+生成的实验方法为取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为H2SO4 ,干扰试验,故做法不合理.
(15分,每空3分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H =+180.5 kJ·mol-1
2C(s)+ O2(g)=2CO(g) △H =-221.0 kJ·mol-1
C(s)+ O2(g)=CO2(g) △H =-393.5 kJ·mol-1
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程 探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:


请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = _________________。
②在该温度下,反应的平衡常数K = 。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明 。
A.该反应的反应物混合后很不稳定 B.该反应使用催化剂意义不大
C.该反应体系达到平衡时至少有一种反应物的百分含量较小

D.该反应在一定条件下能自发进行
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质 为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过 的电流越大,尾气
的电流越大,尾气 中CO的含量越高
中CO的含量越高
知识点:化学
(1)-746.5kJ/mol (无单位扣1分)。【③×2-①-②】
(2) ①v (N2) = 2.25×10-4mol/L.s(无单位扣1分)。
②K = 5000 ③ CD (3)BD
(3)BD
试题分析:(1)按顺序将三个热化学方程式编号为①②③,根据盖斯定律,③×2-①-②可得2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-746.5kJ/mol。 (2)①v (N2) = 1/2 v (NO) =1/2 */2s=1.876mol/(L*s) ②反应到4s 时达到平衡,此时c(N2)=1/2△c(NO)=4.50*10-4mol/L ;c(CO2)=△c(NO)=9.00*10-4mol/L 故化学平衡常数为:K=5000L/mol 。 ③该反应的目的是减小汽车尾气中的污染物,因此反应物的百分含量一定减小,故C项正确;由△H-T△S<0 可知,该反应在一定条件下能自发进行,故D项正确。
(15分)塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂。增塑剂DEHP(C24H38O4)可通过下列流程制备,其中A(C8H16)的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E(C8H6O4)的苯环上存在2种不同化学环境的氢原子。
回答下列问题:

(1)  结构简式:A________________________; E_______________________。
结构简式:A________________________; E_______________________。
(2) 反应类型:B→C____________;D→E____________。
(3)3—甲基庚烷的某同分异构体核磁共振氢谱显示只有一种氢,用系统法命名法命名
该同分异构体________________________________
(4)比B少3个碳原子的同系物有________种同分异构体。
(5) 生成 DEHP的化学方程式___________________________________________(3分)
知识点:化学
(1)CH2=CH(C2H5)(CH2)3 CH3; 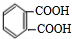
(2)取代反应(或水解);氧化反应
(3)2,2,3,3-四甲基丁烷
(4)8
(5) +2HOCH2CH(CH2CH3)CH2CH2CH2 CH3→
+2HOCH2CH(CH2CH3)CH2CH2CH2 CH3→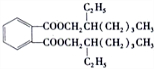 +2H2O
+2H2O
试题分析:A和氢气发生加成反应生成3-甲基庚烷,A的主链上有6个碳原子,则A的结构简式为:CH2=CH(C2H5)(CH2)3 CH3,A和溴化氢发生加成反应生成B,根据题给信息知,B的结构简式为:BrCH2CH(CH2CH3)CH2CH2CH2CH3是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子,则D为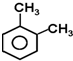 ,邻二甲苯被酸性高锰酸钾溶液氧化生成E为
,邻二甲苯被酸性高锰酸钾溶液氧化生成E为 ,E与C反应得到DEHP,则C应为醇,故B和氢氧化钠的水溶液发生取代反应生成C,C的结构简式为:HOCH2CH(CH2CH3)CH2CH2CH2 CH3,由DEHP分子式及E、C分子式可以知道,E和C以1:2发生酯化反应得到DEHP,则DEHP为
,E与C反应得到DEHP,则C应为醇,故B和氢氧化钠的水溶液发生取代反应生成C,C的结构简式为:HOCH2CH(CH2CH3)CH2CH2CH2 CH3,由DEHP分子式及E、C分子式可以知道,E和C以1:2发生酯化反应得到DEHP,则DEHP为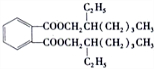 ,
,