人类社会的进步离不开创新的发展。下列行为不符合绿色发展宗旨的是
A.研发煤炭的洁净、高效利用技术,保护生态环境
B.推广CO2的再利用技术,将其合成有价值的化学品
C.利用工业废水灌溉农作物,提高水资源的利用率
D.提高风能、水能、太阳能等可再生清洁能源的使用比例
知识点:化学
C

设NA为阿伏加德罗常数的数值,下列说法正确的是
A.42gC3H6中含有的共用电子对数目为8NA
B.由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA
C.标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA
D.1L0.01mol·L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA
知识点:化学
B
A、C3H6电子式为: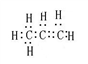 ,42g C3H6物质的量=42g÷42g/mol=1mol,所以电子对数目为9NA,故A错误;
,42g C3H6物质的量=42g÷42g/mol=1mol,所以电子对数目为9NA,故A错误;
B项,CaCO3、KHCO3的摩尔质量均为100g/mol,6gCaCO3为0.06mol,含碳原子数为0.06NA,5gKHCO3为0.05mol,含碳原子数为0.05NA,所以混合物中含碳原子数为0.11NA,故B正确;
C项,标准状况下,22.4L氯气为1mol,56g铁为1mol,由反应2Fe+3Cl2 2FeCl3可得,氯气不足,铁剩余,所以转移的电子数为2NA,故C错误;
2FeCl3可得,氯气不足,铁剩余,所以转移的电子数为2NA,故C错误;
D项,因为KAl(SO4)2溶液中,存在着Al3+的水解,所以1L0.01mol·L-1KAl(SO4)2溶液中含有的阳离子数小于0.02NA,故D错误。综上,选B。
【点睛】本题考查了阿伏加德罗常数的应用,主要是质量换算物质的量计算微粒数,氧化还原反应电子转移计算,盐类水解的分析等,难度一般。注意会写丙烯的电子式、氯气与铁不能恰好完全反应问题。
下列有关说法正确的是
A.分子式为C4H10O的同分异构体有4种
B.可用溴水鉴別苯、四氯化碳和酒精
C.石油分馏后可获得乙烯、丙烯和丁二烯
D.乙二酸与乙二醇生生成聚乙二酸乙二酯的反应属于加聚反应
知识点:化学
B

【点睛】本题考查对有机基础知识的掌握情况,难度不大,但各选项间知识跨度较大,A项注意烃的衍生物中官能团类型异构,C4H10O的同分异构体有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、CH3CH(CH3)CH2OH、CH3C(OH)(CH3)CH3,CH3-O-CH2-CH2-CH3、CH3-CH2-O-CH2-CH3、CH3-O-CH(CH3)-CH3;C项注意石油主要是烷烃混合物、分馏属于物理变化。
下列操作或装置能达到实验目的的是


知识点:化学
D
A项,NO2的密度比空气的密度大,如图装置收集需要“长进短出”,故A错误;B项,NaOH固体能吸水潮解,不能放在滤纸上称量,这样结果会不准确,故B错误;C项,浓硫酸与铜反应,水与过量硫酸结合,铜离子不能与水结合,所以溶液为无色,如图直接加水稀释,会造成液滴飞溅,有危险,故C错误;D项,利用了侯氏制碱法原理,向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO2,因NaHCO3溶解度较小而结晶析出。总反应方程式为:NaCl + CO2 +NH3+H2O=NaHCO3↓+NH4Cl,2NaHCO3 Na2CO3+H2O+CO2↑,故D正确。综上,选D。
Na2CO3+H2O+CO2↑,故D正确。综上,选D。
“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能。用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图。下列有关说法正确的是

A.该电池的总反应为C+O2=CO2
B.煤直接燃烧发电比直接煤燃料电池发电的能量利用率高
C.进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响
D.电子由电极b沿导线流向电极a,入口A加入的物质为煤粉
知识点:化学
A

【点睛】解决此题必须明确原电池工作原理,负极失电子由外电路流向正极,内电路中阴离子与电子构成闭合回路;阳离子与电流构成闭合回路。本题突破口为:熔融盐电解质中CO32-向a极移动,说明a为负极。后续推理过程就容易了许多。
常温下,下列关于溶液的说法不正确的是
①加水稀释FeCl3溶液,c(Fe3+)/c(Cl-)的值减小
②浓度均为0.1 mol·L-l的Na2CO3和Na2HCO3的混合溶液中:2c(Na+)=3
③向0.1 mol/L的氨水中滴加等浓度的盐酸,恰好中和时溶液的pH=a,则溶液中由水电离产生的c(OH-) = 10-amol·L-1
④pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合.反应后所得溶液中: c(CH3COOH)>c(CH3COO-)>c(Na+)
⑤Na2S 稀溶液中:c(OH-) =c(H+)+c( H2S)+c( HS-)
A.②⑤ B.①②⑤ C.②③④⑤ D.①②⑤
知识点:化学
A
①加水稀释FeCl3溶液,促进Fe3+水解使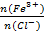 减小,所以
减小,所以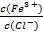 的值减小,故①正确;②浓度均为0.1 mol·L-l的Na2CO3和NaHCO3的混合溶液中:碳原子以CO32-、HCO3-、H2CO3形式存在,根据物料守恒得,2c(Na+)=3,故②错误;③向0.1 mol • L-1的氨水中滴加等浓度的盐酸,恰好中和时生成NH4Cl,H+和OH-都是由水电离产生的,pH=a,则c(H+)=10-a mol • L-1,所以由水电离产生的c(OH-)= c(H+)=10-a mol • L-1,故③正确;④醋酸是弱酸,常温下pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合反应,醋酸过量较多,c(CH3COOH)最大,溶液显酸性,c(H+)> c(OH-),由电荷守恒得:c(CH3COO-)>c(Na+),故④正确;⑤Na2S 稀溶液中存在S2-+H2O
的值减小,故①正确;②浓度均为0.1 mol·L-l的Na2CO3和NaHCO3的混合溶液中:碳原子以CO32-、HCO3-、H2CO3形式存在,根据物料守恒得,2c(Na+)=3,故②错误;③向0.1 mol • L-1的氨水中滴加等浓度的盐酸,恰好中和时生成NH4Cl,H+和OH-都是由水电离产生的,pH=a,则c(H+)=10-a mol • L-1,所以由水电离产生的c(OH-)= c(H+)=10-a mol • L-1,故③正确;④醋酸是弱酸,常温下pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合反应,醋酸过量较多,c(CH3COOH)最大,溶液显酸性,c(H+)> c(OH-),由电荷守恒得:c(CH3COO-)>c(Na+),故④正确;⑤Na2S 稀溶液中存在S2-+H2O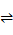 HS-+OH-、HS-+ H2O
HS-+OH-、HS-+ H2O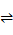 H2S+ OH-,由质子守恒得:c(OH-)=c(H+)+2c(H2S)+c(HS-),故⑤错误。综上,②⑤错误,选A。
H2S+ OH-,由质子守恒得:c(OH-)=c(H+)+2c(H2S)+c(HS-),故⑤错误。综上,②⑤错误,选A。
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下n为气体。m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A.原子半径:Z>Y
B.化合物p中只存在离子键
C.图示转化关系涉及的反应均为氧化还原反应
D.最简单气态氢化物的稳定性:W>X
知识点:化学
C

图示转化关系涉及的反应为:2Mg+CO2 2MgO+C、2CO2+2Na2O2=2Na2CO3+ O2↑、C+O2
2MgO+C、2CO2+2Na2O2=2Na2CO3+ O2↑、C+O2 CO2,均为氧化还原反应,故C正确;D项,W的最简单气态氢化物为CH4,X的最简单氢化物为H2O,故最简单气态氢化物的稳定性:W<X,故D错误。综上,选C。
CO2,均为氧化还原反应,故C正确;D项,W的最简单气态氢化物为CH4,X的最简单氢化物为H2O,故最简单气态氢化物的稳定性:W<X,故D错误。综上,选C。
【点睛】本题是一道有关元素周期表的推断题,要做好此类题目,必须抓住原子结构和元素的有关性质,掌握元素周期表中主要规律,熟悉短周期或前20号元素的性质、存在和用途等,用分析推理法确定未知元素在周期表中的位置。利用已知条件,充分考虑各元素的相互关系进行推断。本题给的信息较多,要从中找到突破口,大胆假设,再根据题目已知条件进行验证,如本题中,由“t的水溶液显碱性且焰色反应呈黄色”可猜测t可能为NaOH、Na2CO3等,再结合转化关系图进一步确定。
铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的简易流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______________。写出铝氢化钠与水反应的化学方程式_____________________。
(2)甲同学设计实验制备无水氯化铝的装置如图所示。

①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是________________。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_________________。
(4)丙同学设计以下4种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。




从易操作性、准确性角度考虑,宜选装置________。铝氢化钠与水完全反应,冷却至室温的标志是______。
知识点:化学
(1)反应放出大量热量使生成的H2迅速膨胀而爆炸 NaAlH4+2H2O═NaAlO2+4H2↑
(2)①吸收剩余的氯气并避免空气中的水蒸气进入D中 ②先将装置A中的分液漏斗打开,反应一段时间,使D中玻璃管充满黄绿色气体
(3)①NaOH溶液(或其他合理答案) ②Na2O2(或Na等其他合理答案)
(4)乙 连续两次读取的H2体积相等

(3)①若用上述装置制备NaH,只要将A中试剂改为金属锌,B中用NaOH等碱性溶液除去挥发出的HCl气体,D中试剂改为金属钠,就可以达到目的。②该装置无法隔绝氧气,,若操作不当,可能会使NaH中含有Na2O2杂质;若氢气不足,Na会有剩余。
(4)丙同学是用测氢气体积的方法来测定NaH样品纯度的,甲装置会导致内部压强大于大气压强,丙装置无法测氢气的体积,丁装置与甲装置类似,会导致结果偏大,故选乙装置;若两次测得的氢气体积相同,则说明已冷却至室温。
【点睛】物质制备实验方案的设计与评价是实验题考查的重点和难点,注意根据实验目的以及物质的性质,结合已知信息分析,保证思路正确、思考方向符合出题者意图。
煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
化学键
H—H
C═O
C═S
H—S
C≡O
E/kJ•mol-1
436
745
577
339
1072
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g)  CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与  的关系如图2所示。
的关系如图2所示。


由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq)  Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______。
知识点:化学
(1)Fe2+(或FeCl2)
(2)①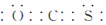
②COS+4Br2+12OH-═CO32-+SO42-+8Br-+6H2O ③+8 ④150℃ 0.048
(3)2.4×10-4(或2.37×10-4)

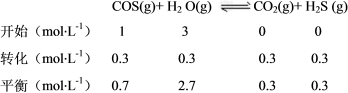
K=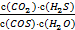 =
=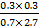 =
=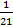 ≈0.048。
≈0.048。
(3)K= 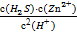 =
=  ÷
÷ 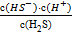 ÷
÷ 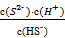 =
=  =
= 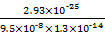 ≈ 2.37×10-4 。
≈ 2.37×10-4 。
【点睛】氧化还原型离子方程式的书写,注意运用得失电子守恒法配平,如本题(2)①中:1molBr2得到2 mol e-,1molCOS失去8 mol e-,所以氧化剂与还原剂物质的量之比为4:1;水溶液中有关平衡常数K的计算,注意运用Ka(或Kb)、Kh、Kw间的关系,列出合适的表达式求算。
马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如下:

(1)软锰矿要先制成矿浆的目的是____________,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__________。
(2)用H2O2溶液“氧化”时发生反应的列子方程式为____________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表所示、“调pH并过滤”时,应调整的pH范围为____________,滤渣1的主要成分为_________(填化学式)。
金属离子
开始沉淀的pH
完全沉淀的pH
Fe3+
1.8
3.2
Al3+
3.0
5.0
Fe2+
5.8
8.8
Mn2+
7.8
9.8
(4)加入磷酸后发生反应的化学方程式为_____________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐__________t。
知识点:化学
(1)增大反应物接触面积,加快反应速率,提高原料利用率 12:1
(2)2Fe2++H2O2+2H+═2Fe3++2H2O
(3)5.0~7.8 Fe(OH)3和Al(OH)3
(4)MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O
(5)2.59(或2.5935)

(2)用H2O2溶液氧化溶液中的亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)根据几种金属离子的氢氧化物开始沉淀和完全沉淀的pH,“调pH并过滤”时,调整的pH的目的是沉淀铁离子和铝离子,但不能使锰离子沉淀,pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3,故答案为:5.0~7.8;Fe(OH)3和Al(OH)3;
(4)碳酸钠与硫酸锰反应生成碳酸锰,加入磷酸使碳酸锰生成Mn(H2PO4)2,反应的化学方程式为MnCO3+2H3PO4 =Mn(H2PO4)+CO2↑+H2O,故答案为:MnCO3+2H3PO4 =Mn(H2PO4)+CO2↑+H2O;
(5)根据MnO2 ~ Mn(H2PO4)2·2H2O
87 285
1t×87%×(1-9%) m
则 =
=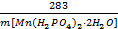 ,解得:m= 2.59t,故答案为:2.59。
,解得:m= 2.59t,故答案为:2.59。
三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为____________。
(2)第一电离能:S______(填“>”、“<”或“=”,下同)P,电负性:S_____P。
(3)三硫化四磷分子中P原子采取_________杂化,与PO3-互为等电子体的化合物分子的化学式为_______。
(4)二硫化碳属于________(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。
(6)叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_____________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为αcm,晶胞中Na+的配位数为______,用NA表示阿伏加德罗常数的数值,NaOH的密度为_______g·cm-3。
知识点:化学
(1)3d104s24p4(或1s22s22p63s23p63d104s24p4)
(2)< >
(3)3p3 SO3
(4)非极性
(5)NA
(6)HN3分子间存在氢键
(7)6 

(3)由图,三硫化四磷分子中与P原子相连的有3个原子,P原子上含有1个孤电子对,采取sp3杂化,根据等电子原理:由短周期元素组成的微粒,只要其原子总数相同、各微粒的价电子总数相同,则互称为等电子体,所以与PO3-互为等电子体的化合物为SO3。
(4)二硫化碳的分子结构与二氧化碳类似,碳原子采取sp杂化,是直线型分子,属于非极性分子。
(5)根据三硫化四磷的分子结构,每个P原子含有1个孤电子对,每个硫原子含有2个孤电子对,所以三硫化四磷分子中含有10个孤电子对,故用NA表示阿伏加德罗常数的值,0.1mol三硫化四磷分子中含有的孤电子对数为NA。
(6)N的电负性较大,HN3分子间存在氢键,所以沸点较高。
(7)NaCl晶胞如图所示
 ,
,
属于立方面心,因为氢氧化钠具有NaCl型结构,以Na+为体心分析,与之相邻的OH-位于面心,晶胞中Na+的配位数为6;因为晶胞中Na+与OH-之间的距离为a cm,所以晶胞棱长为2acm,晶胞体积为(2a cm)3=8a3 cm3,晶胞中Na+离子数目为1+12× =4、OH-离子数目为8×
=4、OH-离子数目为8× +6×
+6× =4,所以晶胞质量为4×
=4,所以晶胞质量为4×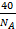 g,故晶胞密度为:4×
g,故晶胞密度为:4×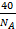 g÷8a3 cm3=
g÷8a3 cm3=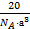 g·cm-3。
g·cm-3。
有机物G是一种常用的植物调味油,可按如下路线合成:

已知:
回答下列问题:
(1)下列关于乙烯的说法不正确的是_________(填字母)。
A.分子中所有原子共平面 B.能发生氧化反应,不能发生还原反应
C.能发生加聚反应生成高分子 D.能使酸性高锰酸钾溶液褪色
(2)由F生成G的反应类型为_________________________。
(3)C中官能团的名称为___________,由C生成D的反应类型为___________。
(4)D的化学名称为___________,由D生成E的化学方程式为___________。
(5)苯环上含有两个取代基,且分子中含有酯基的F的同分异构体有_________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是__________(填结构简式)。
(6)参照上述合成路线,设计以B为原料(无极试剂任选)制备高吸水性树脂 的合成路线:__________________________。
的合成路线:__________________________。
知识点:化学
(1)b (2)消去反应 (3)氯原子 水解反应(或取代反应)
(4)苯甲醇 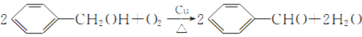
(5)12 
(6)


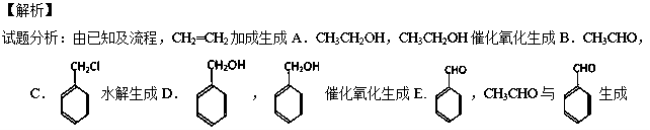 F.
F.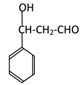 ,
,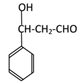 消去生成G.
消去生成G.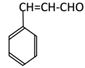 。
。
(1)乙烯为平面型分子,分子中所有原子共面,a正确;乙烯分子中有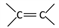 ,能与酸性KMnO4溶液反应使之褪色,与氢气加成反应(属于还原反应),加聚反应生成高分子,所以b错误、c和d正确,故选b。
,能与酸性KMnO4溶液反应使之褪色,与氢气加成反应(属于还原反应),加聚反应生成高分子,所以b错误、c和d正确,故选b。
(2)由上述分析知F. 发生消去反应生成G.
发生消去反应生成G. 。
。
(3)C中官能团为氯原子,C.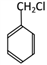 在氢氧化钠溶液中发生水解(取代)反应生成D.
在氢氧化钠溶液中发生水解(取代)反应生成D. 。
。
(4)D为苯甲醇,D→E反应为:2 +O2
+O2 2
2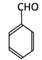 +2H2O。
+2H2O。
(5)F为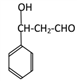 ,F的同分异构体,有苯环、酯基、两个取代基,则为:
,F的同分异构体,有苯环、酯基、两个取代基,则为: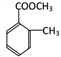 (邻、间、对3种)、
(邻、间、对3种)、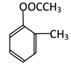 (邻、间、对3种)、
(邻、间、对3种)、 (邻、间、对3种)、
(邻、间、对3种)、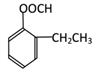 (邻、间、对3种),共有12种;其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是:
(邻、间、对3种),共有12种;其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是: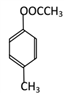 和
和 。
。
(6)以CH3CHO为原料合成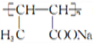 ,需要生成CH3-CH=CH-COONa,结合已知
,需要生成CH3-CH=CH-COONa,结合已知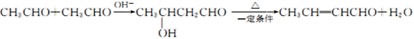 ,流程为:
,流程为:
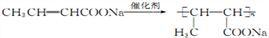 。
。
【点睛】本题考查有机合成与推断,题目整体难度不大。主要考查了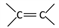 的性质、醇催化氧化成醛、醛氧化成羧酸的性质、卤代烃的水解、醇的消去反应等,注意利用已知信息,理清合成流程,第(6)小题注意运用有机合成逆向分析法。
的性质、醇催化氧化成醛、醛氧化成羧酸的性质、卤代烃的水解、醇的消去反应等,注意利用已知信息,理清合成流程,第(6)小题注意运用有机合成逆向分析法。