下列说法正确的是( )
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,则原溶液一定有Fe3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42-
D.加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
知识点:物质的检验和鉴别
D
略
设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A.0.1 molL-的KAl(SO4)2溶液中,硫酸根离子数为0.2 NA
B.2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA
C.5.6 g铁和1 mol铝一起溶于稀硫酸中,失去电子数为0.6 NA
D.在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA
知识点:化学中常用计量
D
略
下列各组离子在指定的溶液中一定能大量共存的是( )
A.含有Fe3+的溶液:
Na+、SCN-、Cl-、I-
B.含有大量NO3-的溶液:
H+、Fe2+、Cl-、SO42-
C.常温下,pH=12的溶液:
K+、Cl-、SO32-、S2-
D.c(H+)=0.1 mol·L-1的溶液:
Na+、NH4+、SO42-、S2O32-
知识点:离子共存
C
略
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s)![]() 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见下表。下列说法正确的是
( )
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见下表。下列说法正确的是
( )
温度
平衡浓度/ (mol L-1)
c(NH3)
c(CO2)
T1
0.1
T2
0.1
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2平衡时,H2NCOONH4转化的 Δn(T2)=2Δn(T1)
知识点:化学平衡状态及移动
C
略
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液。下列说法中不正确的是(忽略混合前后溶液体积变化) ( )
A.溶液的pH值:②>③>① B.水电离出的c(OH-):③>①>②
C.①和②等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-)
知识点:盐类水解
D
略
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2)∶n(NO)=1∶1时,下列说法正确的是( )
A.产物n[Cu(NO3)2]∶n[CuSO4]=1∶1 B.参加反应的n(Cu2S)∶n(HNO3)=1∶5
C.反应中Cu2S既做氧化剂,又做还原剂D.1 molCu2S参加反应时有8 mol电子转移
知识点:氧化还原反应
C
略
(14分)单质A与粉末化合物B组成的混合物相互转化关系如下图所示:
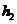
请回答下列问题:
(1)A单质的元素在周期表中处于第______周期______族。
(2)化合物B的电子式为__________________
(3)D与G两溶液混合后发生反应的离子方程式为__________________
(4)常温下,D溶液的pH____________7(填“>”或“<”或”=”),其原因是_______________ ___(用离子方程式表示)
(5 )用碳棒,稀硫酸,气体E和气体F组成燃料电池,该电池的正极反应式为______。
以该电池为电源,用惰性电极电解100 g 8 %的C溶液,当电解到溶质的质量分数为12.5 %时停止电解,则电解过程中,生成的气体在标准状况下的体积共为______L,在电路上通过电子的物质的量为______mol
知识点:无机框图推断
(15分)
(1)三、IIIA(各1分)
(2)![]() (2分)
(2分)
(3)AI3++ 3AIO2- +6H2O= 4AI(OH)3↓(2分)
(4) < (1分) ; AI3+ + 3H2O
![]() AI(OH)3+ 3H+(2分)
AI(OH)3+ 3H+(2分)
(5) O2+4H+ + 4e- = 2H2O(2分), 67.2; (2分) 4 (2分)
略
(14分)氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下面能量变化示意图;请写出NO2和CO反应的热化学方程式____________。
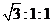
(2)在固定体积的密闭容器中,进行如下化学反应
N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
其平衡常数K与温度T的关系如下表:
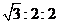
①该反应的平衡常数表达式: K=_____ ____。
②试判断K1_________K2(填写“>”,“=”或“<”)。
③下列各项能说明该反应已达到平衡状态韵是______________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)对反应N2O4(g)![]() 2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示,下列说法正确的是____________。
2NO2(g) △H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示,下列说法正确的是____________。
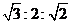
a.A、C两点的反应速率:A>C b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在l L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=___________, 以NH3表示该过程的反应速率v(NH3)=______________。
知识点:化学反应速率和化学平衡的计算
(13分)

略
(15分)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为5.48×10-7,饱和亚硫酸中c(SO32-)=6.3×10-8mol·L-1。
(1)将0.1mol·L-1的BaCl2溶液滴入饱和亚硫酸中, (填“能”或“不能”)生成BaSO3沉淀,原因是 (请写出必要的推断过程)。
(2)浓硫酸的沸点为338°C,酒精灯火焰的温度为400~500°C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式: ;
②白色沉淀的化学式是 ,请用离子方程式表示生成该白色沉淀的可能原因
。
(3)乙同学认为甲同学的装置不完善,设计了改进装置Ⅱ进行实验(夹持装置和A中加热装置已略,气密性已检验)。
①打开弹簧夹,通入N2一段时间后关闭弹簧夹;
③滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是 ,洗气瓶B中的试剂是 。
(4)丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色
沉淀,丙滴加的试剂可能是 。
A.NaOH溶液 B.NaAlO2溶液 C.H2O2溶液 D.酸性KmnO4溶液
知识点:溶解平衡
(15分)(1)不能(1分) 此时溶液中c(Ba2+)<0.1 mol· L-1 , c(SO32-)<6.3×10-8mol· L-1,
其浓度商Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7(2分)
(2)① Cu + 2H2SO4(浓) ![]() CuSO4+
SO2↑+ 2H2O(2分)
CuSO4+
SO2↑+ 2H2O(2分)
② BaSO4(1分)
Ba2++ SO42-= BaSO4↓(2分) 2 Ba2++ 2SO2 + O2+2H2O= 2BaSO4↓+ 4H+(2分)
(3)排除装置内的空气(O2)(1分) 饱和NaHSO3溶液(2分) (4)C(2分)
略
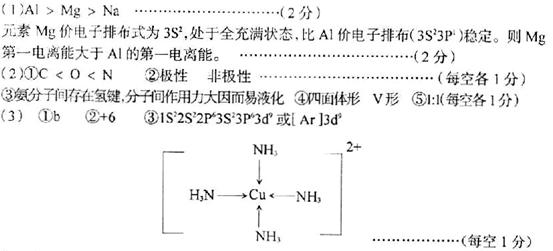
(15分)【化学一选修3物质结构与性质】
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
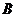
则X、Y、Z的电负性从大到小的顺序为______ (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是___ ___。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化。
①A、B、C的第一电离能由小到大的顺序为______ (用元素符号表示)。
②M是含有____ __键的______分子(填“极性”或“非极性” )
③N是一种易液化的气体,请简述其易液化的原因______。
④W分子的VSEPR模型的空间构型为______,W分子的空间构型为______。
⑤AB-离子中和B2分子的![]() 键数目比为_______________。
键数目比为_______________。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1。
①E元素组成的单质的晶体堆积模型为_________ (填代号)
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积
d.面心立方最密堆积
②F元素在其化合物中最高化合价为_____。
③G2+离子的核外电子排布式为__________,G2+和N分子形成的配离子的结构式为________
知识点:晶体结构与性质
(15分)【化学一选修3物质结构与性质】
略
(15分)【化学一选修5有机化学基础】
互为同分异构体的有机物A、B、C的分子式均为C5H8O2,其中A为直链结构,加热时能与新制的氢氧化铜浊液反应,生成砖红色物质;A分子中核磁共振氢谱图中有三组峰,且峰面积之比为2:1:1。B为五元环酯。C的红外光谱表明其分子中存在甲基。A-I等有机物的转化关系如下:
乙知:烯烃在一定条件下可与卤素单质发生a—H原子的取代反应。
如: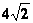
请回答下列问题:
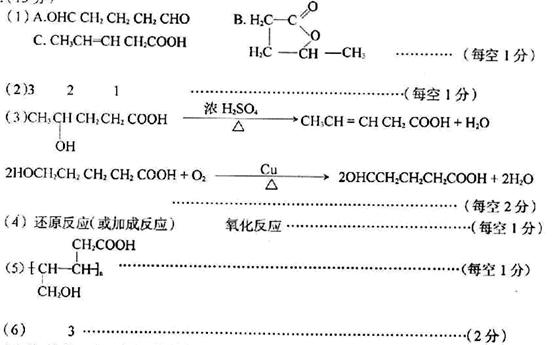
(1 )A、B、C的结构简式分别是:A_____,B_____,C_____
(2)E、G J分子中的官能团种数(不同官能团的个数)分别为:
E_____,G_____,I_____
(3)写出下列反应的化学方程式;
D→C: _____________________________________________
G→H: _____________________________________________
(4)写出下列反应类型:
F→G_____________________________________________
A→I中的①________________________________________
(5)写出F发生加聚反应生成的产物的结构简式_______________
(6)与A的官能团组成和个数均相同的同分异构体还有__________个。
知识点:有机化学知识综合应用
(15分)【化学一选修5有机化学基础】
略