下列叙述中,不能用平衡移动原理解释的是: ( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.氯气在水中溶解度大于饱和食盐水中的溶解度
D.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快
知识点:化学平衡状态及移动
D
略
已达化学平衡的反应:2X(g)+Y(g)![]() 2Z(g),减小压强时,对反应产生影响是( )
2Z(g),减小压强时,对反应产生影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
知识点:化学平衡状态及移动
C
略
一定条件下的反应:PCl5(g)![]() PCl3(g)+Cl2(g) △H>0达到平衡后,下列情况使PCl5分解率降低的是
( )
PCl3(g)+Cl2(g) △H>0达到平衡后,下列情况使PCl5分解率降低的是
( )
A. 温度、体积不变,充入氩气 B. 体积不变,对体系加热
C. 温度、体积不变,充入氯气 D. 温度不变,增大容器体积
知识点:化学平衡状态及移动
C
略
下图为可逆反应A(g)+2B(g)![]() nC(g) △H>0生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是
( )
nC(g) △H>0生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1、p2的关系正确的是
( )
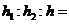
A. p2>p1,n<3 B. p2>p1,n>3
C. p1>p2,n<3 D. p1>p2,n>3
知识点:化学平衡状态及移动
D
略
体积相同,浓度均为0.1 mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为 ( )
A.4m=n B.m=n C.m<n D.m>n
知识点:弱电解质的电离
D
略
1体积pH=2.5的盐酸和10体积一元强碱溶液恰好完全反应,则碱溶液的pH等于( )
A. 9.0 B. 9.5 C. 10.5 D. 11.5
知识点:水的电离和溶液的酸碱性
C
略
在密闭容器中反应:aX(g)+bY(g)![]() cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
)
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
)
A.a+b>c+d B.平衡向逆反应方向移动
C.Z的体积分数减小 D.X的转化率下降
知识点:化学平衡状态及移动
A
略
在一密闭烧瓶中,在25℃时存在着平衡2NO2 ![]() N2O4
△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
( )
N2O4
△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A ①和③ B ②和④ C ④和⑤ D ③和⑤
知识点:化学平衡状态及移动
D
略
常温下,0.1mol·L-1某一元酸(HA)溶液中C(H+)=1×10-3,下列叙述正确的是( )
A.该一元酸溶液的pH=1
B.该溶液中HA的电离度为 1%
C.该溶液中水的离子积常数为1×10-22
D.若加水稀释,则C(OH-)/C(H+)将减小
知识点:弱电解质的电离
B
略
下列各组离子一定能大量共存的是 ( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在使酚酞变红的溶液中:Na+、K+、AlO2—、CO32—
C.在由水电离出的c(H+)=10—13mol/L的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
知识点:离子共存
B
略
中和相同体积、相同pH值的H2SO4、HCl和CH3COOH三种稀溶液,所需相同浓度的NaOH溶液的体积为V1、V2和V3,则 ( )
A、V1>V2>V3 B、V3>V2>V1 C、V3>V1=V2 D、V1>V2=V3
知识点:弱电解质的电离
C
略
用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是 ( )
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
知识点:仪器和基本操作
C
略
液氨与水的电离相似,存在关微弱的电离:NH3+NH3![]() NH4++NH2-。对该体系的说法中错误的是
( )
NH4++NH2-。对该体系的说法中错误的是
( )
A.液氨中c(NH4+)与c(NH2-)的乘积为一常数
B.液氨电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-)
C.只要不加入其它物质c(NH4+)=c(NH2-)
D.液氨中存在NH3、NH4+、NH2-等粒子。
知识点:弱电解质的电离
B
略
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)
的关系如图示,下列说法不正确的是 ( )
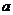
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
知识点:弱电解质的电离
A
略
(10分)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 。
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值将 (填“增大”“减小”或“不变”,下同),该反应的化学反应速率将 。
知识点:化学平衡状态及移动

略
(13分).已知可逆反应:Fe(s) + CO2(g)![]() FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
T(K)
938
1173
K
1.47
2.15
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
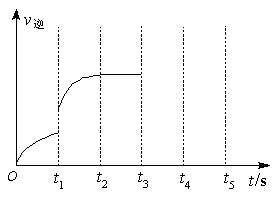
(3)该反应的逆反应速率随时间变化情况如右图所示。
①从右图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件可能是_______(选填编号)。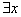
a.升高温度 b.增大CO2的浓度 c.减小CO2的浓度 d.使用催化剂

知识点:化学平衡状态及移动
略

(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是______________。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为____________。反应所需时间的长短关系是__________。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
________________________________________________________________________。
知识点:水的电离和溶液的酸碱性
(14分)(1) b>a>c
(2) b>a=c
(3) c>a>b
(4) c>a=b
(5) a=b=c ; a=b>c
(6) c>a=b
略
(13分)Ⅰ。实验室为测定一新配制的稀盐酸的准确浓度,通常是用纯净的Na2CO3(无水)配成标准溶液滴定。具体操作是:称取wg纯净的无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4~5之间,那么指示剂宜选 ,当滴定至溶液由
色变为 色时,即表示到达终点;
(2)若滴定到终点时,消耗盐酸的体积为VmL,则盐酸的物质的量浓度为____ ____mol/L。
Ⅱ。用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中(填仪器),加适当的指示剂;
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手 ,右手 ,两眼注视 ,直到滴定终点。
滴定次数
待测液体积/mL
标准盐酸体积/mL
滴定前读数(mL)
滴定后读数(mL)
第一次
10.00
0.50
20.40
第二次
10.00
4.00
24.10
第三次
10.00
4.20
25.70
(4)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
知识点:水的电离和溶液的酸碱性
(13分)Ⅰ.(1) 甲基橙 ; 黄 ; 橙 。
(2) 1000W/53V
Ⅱ.(2) 碱式滴定管来量取 ,
(3)滴定过程中,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点。
(4)80.00%
略