 (共5分)
化学生物学是一门新兴交叉学科。专家们期望它能是用数学模型、物理手段研究生命体系中的化学过程。过氧化物酶(POD)是一种底物十分广泛的氧化还原酶类,是在细胞基质中合成的含有血红素辅基的金属酶,广泛存在于动、植物中,参与体内多种生理生化反应。其分子量为4~5万道尔顿,约由300个左右的氨基酸残基和血红素辅基组成(见 POD模型示意图)。
(共5分)
化学生物学是一门新兴交叉学科。专家们期望它能是用数学模型、物理手段研究生命体系中的化学过程。过氧化物酶(POD)是一种底物十分广泛的氧化还原酶类,是在细胞基质中合成的含有血红素辅基的金属酶,广泛存在于动、植物中,参与体内多种生理生化反应。其分子量为4~5万道尔顿,约由300个左右的氨基酸残基和血红素辅基组成(见 POD模型示意图)。
中心铁Fe (Ⅲ)的一个轴向配体是组氨酸咪唑氮原子,另一个轴向配体可能是小分子(H2O、CN-、F-、SCN-、SO32-等)。
(1) 研究发现,上述轴向配体均会不同程度地使Fe (Ⅲ)卟啉活性中心的电子云密度有所变化,其主要原因是改变了Fe(Ⅲ)的自旋状态。请以L=CN-、F-为例从理论上推断它们是怎样影响Fe (Ⅲ)自旋状态的?
(2) 生物学研究表明,大量重金属离子Cu2+、Zn2+、Cd2+、Hg2+、La3+、Pb3+、Tb3+进入生物体,会对上述酶产生较强的影响,它们通过与酶蛋白中相应原子作用(键合)改变酶的二级结构(构象)。其化学过程研究可采用多种光谱技术及电化学手段。例如,用紫外-可见(UV-vis)吸收光谱法可获得生物分子中生色基团周围环境信息等。POD的活性中心是血红素辅基,其特征吸收光谱由三个部分组成,即:铁卟啉的π-π*跃迁,过渡金属的d-d跃迁,以及配体和金属Fe (Ⅲ)离子间的荷移跃迁光谱,在200 nm附近出现酶蛋白特有的肽链中酰氨基或羧基产生的强吸收峰。当重金属离子作用时,其特征吸收峰的位置与强度均会发生变化,展示出酶蛋白的二级结构(构象)被改变,进而导致Fe(Ⅲ)周围电子云密度变化,使氧化还原的电子传递能力受到影响,引起酶的催化活性与功能的改变。
La3+能明显地使酰氨基或羧基200nm处的特征峰吸收值下降,说明La3+有可能与其中O或N配位(结合其它手段确认是与O键合),导致POD酶蛋白的活性中心电子云密度改变(即400nm处吸收带下降)。但Cu2+、Hg2+使酶的特征吸收峰值(200nm处)变化很小,而 400nm处吸收带变化与La3+相同。这是因为La3+可与 键合,Hg2+可与 键合,Cu2+可与 键合,从而改变POD构象,上述分析的依据是 理论。
知识点:原子结构与性质
(共5分) (1) L = CN-(强场) F-(弱场)
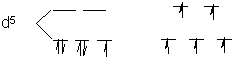
Fe(Ⅲ) 低自旋 高自旋
稳定化能 大 小
稳定性 强 弱 ……(3分)
(2) O S O、N、S 软硬酸碱 ……………(3分)
略