下列说法中正确的是 ( )
A.氮的固定只有在高温、高压、催化剂的条件下才能实现
B.纯净的硅单质的制造光导纤维的基本原料
C.生理盐水、葡萄糖注射液属于胶体
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
知识点:化学与技术
D
略
有关![]() ( )
( )
A.相同温度下,等浓度的![]() 溶液的碱性比较,前者更强
溶液的碱性比较,前者更强
B.常温时水溶性:![]()
C.在酒精灯加热的条件下,前者不分解,后者分解
D.将澄清的石灰水分别加入![]() 溶液中,前者产生沉淀,后者无现象
溶液中,前者产生沉淀,后者无现象
知识点:钠和碱金属
D
略
若![]() 表示阿伏加德罗常数,下列说法中正确的是( )
表示阿伏加德罗常数,下列说法中正确的是( )
A.常温常压下,![]() 气体中所含的分子数
气体中所含的分子数![]()
B.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为![]()
C.![]() 溶液中,阴阳离子总数为
溶液中,阴阳离子总数为![]()
D.![]()
知识点:物质的量的计算
A
略
下列说法正确的是 ( )
A.将SO2通入溶有足量氨气的BaC12溶液中,无沉淀生成
B.将盐酸KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
C.在一定条件下,Na、Mg、Fe等金属与水反应都生成H2和对应的碱
D.新制氨水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
知识点:元素及其化合物的综合运用
B
略
下列操作中,能使电离平衡H2O![]() H++OH—向右移动且溶液呈碱性的是( )
H++OH—向右移动且溶液呈碱性的是( )
A.向水中通入氨色 B.向水中加入A12(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使Ph=6
知识点:水的电离和溶液的酸碱性
C
略
某无色气体X,可能含有CO2、SO2、HC1、HBr中的一种或几钟。将X通过适量的氯水时,X完全被吸收。将所得的无色溶液分装于两支试管后,分别加入酸化AgNO3与BaC12溶液,结果均产生白色沉淀。下列推论正确的是 ( )
A.X中可能有HBr B.X中一定有SO2
C.X中一定没有CO2 D.X中一定有HC1
知识点:物质的检验和鉴别
B
略
下列离子方程式表示正确的是 ( )
A.AgNO3溶液中加入Cu:Cu+ Ag+ ![]() Cu2++Ag
Cu2++Ag
B.NaHCO3溶液中加入CH3COOH:![]()
![]()
![]()
C.含![]()
![]()
![]()
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:![]()
![]()
![]()
知识点:离子方程式
D
略
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。对下列反应的推断或解释正确的是 ( )
操作
可能的实验现象
解释
A
某溶液中加入硝酸酸化的氯化钡溶液
有白色沉淀生成
溶液中一定含有![]()
B
将SO2通入![]() 溶液中
溶液中
有白色沉淀生成
SO2与Ba(NO3)2反应生成BaSO3
C
同温同压下,有pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性
碳酸钠溶液显碱性,硫酸钠溶液显中性
碳酸钠发生了水解
D
向淀粉KI溶液中通入C12
溶液变蓝
C12与淀粉发生显色反应
知识点:物质的检验和鉴别
C
略
下列各项操作中,不发生“先产生沉淀,后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀硫酸③向AgNO3溶液中逐滴加和过量氨水④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
知识点:离子反应
C
略
金属铜的提炼多从黄铜矿开始,黄铜矿的熔烧过程主要反应之一为:2CuFeS2+O2 ==CuS
+2FeS+SO2,则下列说法正确的是 ( )
A.2CuFeS2中的S为—2价
B.CuFeS2仅是还原剂
C.横线上的物质应是CuS
D.若有1mo1O2参加反应,则反应中有4mo1电子转移
知识点:氧化还原反应
A
略
将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的X气体(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。气体X的成分可能是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
知识点:物质的量的计算
B
略
将一块镁铝的合金投入![]() ·
·![]() 的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入
的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入![]() ·
·![]() 的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位
的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位![]() )的关系如图。下列说法中不正确的是 ( )
)的关系如图。下列说法中不正确的是 ( )
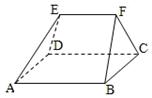
A.由图可以确定该镁铝合金中铝的质量为0.27g
B.当滴入![]() ·
·![]() 的NaOH溶液85mL时,所得沉沉淀的成分为Mg(OH)2和A1(OH)3
的NaOH溶液85mL时,所得沉沉淀的成分为Mg(OH)2和A1(OH)3
C.由图可以确定a的取值范围为:![]()
D.由图可以确定该合金中镁铝物质的量之比![]()
知识点:物质的量的计算
C
略
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2 ![]() 2NaFeO4+2Na2O+2Na2SO4+O2↑
2NaFeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是 ,还原剂是 ,每生成1mo1Na2FeO4转移 mo1电子
②简要说明K2FeO4,作为水处理剂时,在水处理过程中所起的作用
。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、![]() 、C1-、H2O。
、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成![]() 转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质量为
mo1。
转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质量为
mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
知识点:氧化还原反应

略
A~L为中学化学常见物质,其主要转化关系如右图所示(其中产物水已略去)。已知A为金属单质,C、D通常状况下为气体单质。B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L。G和I分别由相同的两种元素组成,通常状况下均为无色液体。
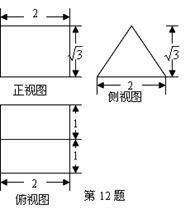
(1)B的化学式 ;工业上
冶炼金属A的方法称为 。
(2)向E的溶液中加入氢氧化钠的实验现象为 ,
反应的化学方程式为 。
(3)写出E的酸性溶液与G反应转化的H的离子方程式 。
(4)相同条件下,物质的量浓度相同的K、L溶液中,pH大的为 溶液(填化学式)。
知识点:无机框图推断

略
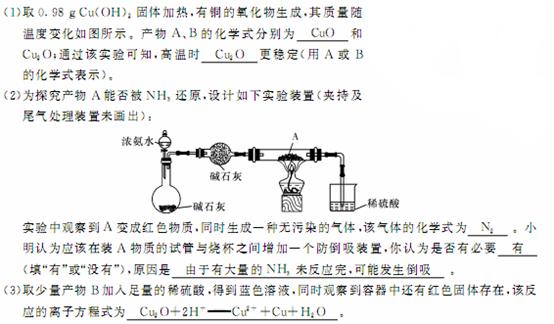
师大附中某化学研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:

(1)取0.98gCu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图所示。产物A、B的化学式分别为
和Cu2O;通过该实验可知,主温时 更稳定(用A或B的化学式表示)
(2)为探究产物A能否被NH3还原,设计如下实验装置(夹持及尾气处理装置未画出):

实验中观察到A变成红色物质,同时生成一种无污染的气体,该气体的化学式为 。小明认为应该在装A物质的试管与烧杯之间增加一个防倒吸装置,你认为是否有必要
(填“有”或“没有”),原因是 。
(3)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为 。
知识点:综合性实验
略
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制
得: SiO2+
C+ N2![]() Si3N4+
CO。(
)
Si3N4+
CO。(
)
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20m01氮气,反应生成了5mo一氧化碳,则反应中转移电子数为 NA,此时混合气体的平均相对分子质量是 。
(3)分析反应可推测碳、氮气的氧化性:C N2(填“>”“<”“=”)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是 。
A.可以在冶金工业上制成坩埚、铝电解槽衬里等热工设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发,将受到资源的限制,发展前余暗谈
知识点:基本概念、基本理论的综合运用

略
附中某化学兴趣小组为探索铜跟浓硫酸的反应,用下图所示装置进行有关实验。

郝欣同学取a g Cu片12![]() 18mo1/L浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
18mo1/L浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
请回答:
(1)请写出Cu与浓H2SO4反应的化学方程式 。
装置E中试管D内盛品红溶液,当C中气体集满,D中有可能观察到的现象是 。
(2)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于作热的作用,A处仍有气体产生,此时B中现象是 。B中应放置的液体: (填字母)。
A.饱和Na2SO3溶液 B.酸性KMnO4
C.浓溴水 D.饱和NaHSO3溶液
(3)下列药品中,能够证明反应后的烧瓶中有酸剩余的是 。
A.Fe粉 B.BaC12溶液 C.Ag D.饱和NaHSO3溶液
(4)小明同学向A中反应后的溶液中通入氧气,发现铜片全部溶液,且仅生成硫酸铜溶液该化学反应方程式是 。
知识点:综合性实验

略
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有C1-、C1O-、![]() 三种含氯元素的离子,其中C1O-、
三种含氯元素的离子,其中C1O-、 ![]() 两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
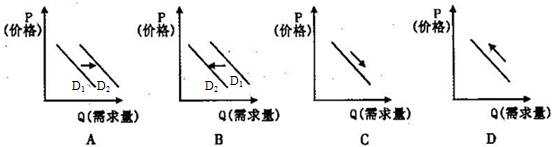
(1)t1时,Ca(OH)2与C12发生反应的离子方程式为 。
(2)t2时![]() ,此时,Ca(OH)2与C12 发生反应的总化学方程式为
,此时,Ca(OH)2与C12 发生反应的总化学方程式为
。
(3)该石灰乳中含有Ca(OH)2的物质的量是 mo1。
(4)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和![]() 的比也不同。
的比也不同。
①若在原石灰乳中通入氯气的速度加快,则反应后![]() 。(填“>”“<”“=”)
。(填“>”“<”“=”)
②若![]() a,则n(C1-)=
mo1(用含a的代数式表示)。
a,则n(C1-)=
mo1(用含a的代数式表示)。
知识点:化学计算的综合运用

略