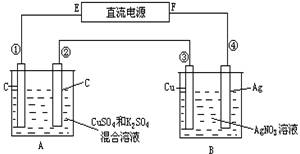
如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL。
试求:
(1)请写出①、②的电极反应式;
(2)通电前A池中原混合溶液Cu2+的浓度。
知识点:电解池
在A池中发生的反应为:阳极(②极):4OH-- 4e-=2H2O+O2↑
阴极(①极):2Cu2++4e-=2Cu
若Cu2+完全放电后还有:4H++4e-=2H2↑ 转移电子的物质的量为:2.16÷108=0.02(mol)
由电极反应可知,每转移4mol电子,放出1molO2,所以②极上析出O2的体积为:
0.02÷4×22.4=0.112(L)<0.224(L)
说明A池收集到的气体中还有H2。①极上放出H2为:0.224-0.112=0.112(L),即0.005mol。
①极上析出Cu和放出H2共获得0.02mol电子。
Cu2+的物质的量为:(0.02-0.005×2)/2=0.005mol [Cu2+]=0.005/0.2=0.025mol/L
答:通电前A池中原混合溶液Cu2+的浓度为0.025mol/L。