2011年为国际化学年,主题为“化学—我们的生活,我们的未来”。下列说法错误的是
A.化学是在原子、分子水平上研究物质的科学
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料。利用该技术能改变合成路径,降低反应发生的条件.
D.明矾净水是利用的胶体的吸附作用
知识点:化学与社会的相互关系
B
略
若NA表示阿伏加德罗常数的数值,下列说法正确的是:
A.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
B.标准状况下,2.24
L
CHCl3的分子数为0.1 NA
C.t℃时,1LpH=6的纯水中,含1×10-6
NA个OH-
D.日本核泄漏的放射性物质含有131I,131I和127I互为同素异形体
知识点:化学中常用计量
C
略
下表是部分短周期元素的原子半径及主要化合价。
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
以下叙述正确的是
A.气态氢化物的稳定性为H2T<H2R
B.M和T能形成一种极有前途的高温结构陶瓷
C.单质与稀盐酸反应的速率为L<Q
D.R和T形成的化合物中含有离子键
知识点:元素周期律与元素周期表
B
略
下列说法正确的是
A.可食用植物油含有的高级脂肪酸甘油酯是人体的营养物质
B.分馏、干馏都是物理变化,裂化、裂解都是化学变化
C.淀粉、蛋白质、葡萄糖都是高分子化合物
D.甲烷、汽油、柴油、酒精都是碳氢化合物,都可作燃料
知识点:蛋白质和核酸
A
略
下列实验操作正确的是
A.测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润
B.容量瓶用蒸馏水洗净、必须烘干后才能用于溶液的配制
C.用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出
D.中和滴定时,锥形瓶需要用待测液润洗后才能使用
知识点:仪器和基本操作
C
略
甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3·H2O、Na2CO3中的一种。 常温下进行如下实验:①将0.1 L pH=9的甲溶液分别与a L 0.001 mol/L的乙溶液、b L 0.001 mol/L的丁溶液充分反应后溶液呈中性时,a>b;②浓度均为0.1 mol/L的丙和丁溶液等体积混合后,溶液呈酸性;③0.1 mol/L的甲溶液pH小于0.1 mol/L的戊溶液pH。下列判断正确的是
A.甲的溶质是NH3·H2O B.乙的溶质是CH3COOH
C.丙的溶质是NaOH D.戊的溶质是HCl
知识点:盐类水解
B
略
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与实践的关系如图(II)所示,则下列结论正确的是
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+10)min时,保持容器体积不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol.L-1 A、0.1mol.L-1 B和0.4mol.L-1 C反应,达到平衡后,C的浓度仍为0.4mol.L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
知识点:化学平衡状态及移动
C
略
(15分)
钛是一种重要的金属,工业上用钛铁矿(FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TiO2),TiO2常通过两种方法还原可制得Ti。
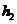
其中,2H2SO4+FeTiO3 =TiOSO4 +FeSO4+2H2O。回答下列问题。
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH=Na2SiO3 +H2O和 。
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是:
。
(3)TiOSO4是一种强酸弱碱盐。从TiOSO4→H2TiO3需要加热,则加热的目的是_________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为___________________________________。
(5)因为TiO2
(s)+2Cl2
(g)![]() TiCl4(l)+O2
(g);ΔH=+151 kJ/mol反应难于发生,所以工业上不能直接由TiO2
和Cl2反应来制取TiCl4。当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同)。
TiCl4(l)+O2
(g);ΔH=+151 kJ/mol反应难于发生,所以工业上不能直接由TiO2
和Cl2反应来制取TiCl4。当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同)。
2C(s)+O2 (g) =2CO (g);ΔH=-221 kJ/mol。
TiO2 (s)+2C (s)+2Cl2
(g) ![]() TiCl4 (l)+2CO (g);ΔH=
。
TiCl4 (l)+2CO (g);ΔH=
。
(6)从化学平衡的角度解释:往TiO2 和Cl2反应体系中加入碳后,能使反应TiO2
(s)+2Cl2
(g)![]() TiCl4(l)+O2
(g)顺利进行的原因是
。
TiCl4(l)+O2
(g)顺利进行的原因是
。
知识点:物质的分离、除杂和提纯
略
略
(12分)I.一定条件下铁可以和CO2发生反应:Fe+CO2![]() FeO(s)+CO(g)。已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g)。已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
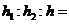
甲 乙
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。5min内,CO的平均反应速率v(CO)=
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.再加入一些铁粉
II.下图装置中甲烧杯盛放100 mL0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。取出Cu电极,洗涤干燥称量,电极增重 0.64 g。
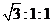
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 ;
② 乙烧杯中电解反应的离子方程式为 ;
③ 甲、乙两烧杯中生成的气体标准状况下共 mL。
知识点:基本概念、基本理论的综合运用
(共12分)(1)0.1mol/(L.min)(2分)(2)A(2分)
电解
(3)①
正(2分)
Fe - 2e-=== Fe2+(2分)
② 2Cu2++
2H2O 2Cu + O2↑
+ 4H+ (2分)
③ 336 (2分)
略
(15分)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
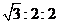
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是: ;C的作用是: 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为 (写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是(答一条即可)
。
知识点:铁及其化合物
(15分)(1)常温下Fe遇浓硫酸发生钝化(2分)
(2)C + 2H2SO4(浓) ![]() CO2↑ + 2SO2↑
+ 2H2O(2分)
CO2↑ + 2SO2↑
+ 2H2O(2分)
(3)品红溶液褪色(2分,或“颜色变浅”) 除尽反应产物中的SO2气体(2分)
(4)(11m-3b)/11m(3分)
(5)装置内的CO2难以赶尽,导致E质量增重偏小(2分)
(6)SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O(其它合理的也得分) (2分)
略
[物质结构与性质选修模块](8分) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。
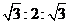
血红素的结构式
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式 。
⑵血红素中N原子的杂化方式为 ,在下图的方框内用“→”标出Fe2+的配位键(在答题纸上画出简略图)。
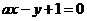
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
知识点:晶体结构与性质
(8分)⑴C O N(1分) ; [Ar]3d64S2(1分) ⑵sp2和 sp3 (2分) ; 如图(1分)
⑶4 (1分); 4∶3(2分)
略
[有机化学基础选修模块](8分)
某有机物A是一种重要中间体。
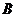
(1)已知有机物A的相对分子质量不超过180,若将A完全燃烧,只生成CO2和H2O,且n(CO2) : n(H2O)=7:5,反应中消耗的O2和生成的CO2的物质的量相等,有机物A的分子式为 。根据有机物A能与NaHCO3反应放出气体,可知A分子中含有的官能团的名称是 。
(2)已知碳碳双键上接羟基时,或者一个碳原子上同时连接2个或2个以上羟基时不能稳定存在。有机物A分子中有四个相邻的取代基, C分子的碳环上的一氯取代物只有两种结构。则B的结构简式为 。
(3)写出下列反应的化学方程式。
C![]() D:
。
D:
。
(4)C的同分异构体中,含有三个取代基的异构体共有 种。
知识点:有机化学知识综合应用
(8分)(1)C7H10O5(1分);羧基(1分)
(2)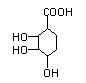 (2分)
(2分)
(3) ![]() + C2H5OH
+ C2H5OH ![]()
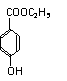 + H2O
(2分)
+ H2O
(2分)
(4)6
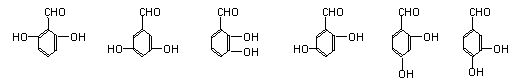 (2分)
(2分)
略