下列有关物质分类或归纳的说法中,正确的一组是
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯、聚氯乙烯、纤维素都属于合成高分子
③明矾、石膏、冰醋酸、水都是电解质
④盐酸、漂白粉、水玻璃都是混合物
⑤分馏、干馏、裂化都是化学变化
⑥植物油、直馏汽油都可与溴水反应
A.①③⑤ B.②④⑥ C.①③④ D.②⑤⑥
知识点:物质的分类
C
设NA为阿伏加德罗常数,下列叙述中正确的是


A. c(H+)=0.1mol/L的甲酸溶液中,HCOO-和H+ 数目之和为0.1 NA
B. 标准状况下,3.36L乙烯中含有的极性键数为0.60 NA
C. 1L 0.2mol/L的Fe2(SO4)3溶液中含0.4NA个Fe3+离子
D. 1mol油酸含有的双键数目约为NA
知识点:物质的量
B
下列叙述正确的是
A.用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分 别为Va和Vb, 则Va =10 Vb
B.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有:
C(NaOH)<C(CH3COONa)<C(NaHCO3)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
D.向Ca(HCO3)2溶液加少量氢氧化钠溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
知识点:离子浓度比较
C
某有机物A的结构简式如右图所示,

下列有关叙述正确的是
A.l mol A最多可以与2mol Br2发生反应
B.A在一定条件下可以发生消去反应和取代反应
C.一个A分子中最多有8个碳原子在同一平面上
D.1 mol A与足量的NaOH溶液反应,最多可以消耗3 mol NaOH
知识点:有机化学知识综合应用
B
有四种金属分别用a、b、c、d表示。①这四种金属两两组成原电池时,a都是正极;②这四种金属可以 用盐酸把它们区分为a、d和b、c两组;③在用盐酸处理后的溶液中加入足量的强碱,可知b离子先沉 淀后溶解,且b、c同在第三周期,判断四种金属活泼性由强到弱的顺序为
A.c、b、d、a B.a、b、c、d C.a、c、b、d D.d、b、c、a
知识点:基本概念、基本理论的综合运用
A
铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480 mL 的NO2气体和336 mL的N2O4气体(均为标准状况下),在反应后的溶液中加入足量的NaOH溶液,生成的沉淀的质量为
A.7.04g B.8.26g C.8.51g D.9.02g
知识点:化学计算的综合运用
C
(14分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
I.由表中数据判断ΔH2 0(填“>”、“<”或“=”)。
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离出来 C.使用合适的催化剂
D.充入He,使体系总压强增大 E.按原比例再充入CO和H2
Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的原电池装置。
①该电池工作时,OH-向_______极移动(填“正”或“负”),
②该电池正极的电极反应式为 。
知识点:基本概念、基本理论的综合运用
(1)① Ⅱ
② I.<
Ⅱ.BE
Ⅲ.80% 250℃
(2)① 负
② O2+2H2O+4e- 4OH- (每空2分)
4OH- (每空2分)
(15分)现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种强酸的酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答:

(1)X与B反应的离子方程式为 。
(2)D溶液pH值大于7,原因是(用离子方程式表示) 。
(3)写出C与过量B反应(加热)的离子方程式 _________________ 。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序_____________________.
(5)Y在同主族的同类物质中分子稳定性最强( ),也是沸点最高的( )。(判断正误填"是"或"否")
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为 △H1 ,△H2 ,△H3 ,则三者由大到小排序为:______________.
知识点:无机框图推断
(1) Al(OH)3+OH— = AlO2— +2H2O(3分)
(2)CO32—+ H2O 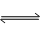 HCO3—+OH— (3分) (3)NH4+ +H+ +2OH—
HCO3—+OH— (3分) (3)NH4+ +H+ +2OH— NH3↑ +2H2O(3分)
NH3↑ +2H2O(3分)
(4)C(Na+)>C(SO42-)>C(NH4+ )>C(H+) = C(OH-) 2分)
(5) 是 ,否 (各1分) (6) △H1 >△H2 >△H3 (2分)
(14分)
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(85%)==Na2SO4 + SO2↑+ H2O

(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是 、 、 。

(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是 。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因 ,验证方法
② 原因 ,验证方法
③ 原因 ,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为
%(用含a、b的代数式填写)
知识点:综合性实验
(1) B A E(2分,错写1个扣1分,至0分,其它合理答案均给分)
(2)先加热催化剂再滴入浓硫酸 (2分)
(3)①原因 Na2SO3变质 (1分),验证方法 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质(2分)
②原因 不是浓硫酸 (1分),验证方法 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸 (2分)(其他答案合理也给分)
(4)SO2 + 2HClO3 = H2SO4 + 2ClO2(2分)
(5)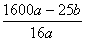 %(或者
%(或者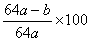 %) 2分,
%) 2分,
[化学——选修化学与技术](15分)
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
⑴火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O2 2ZnO+2SO2;鼓风炉中:2C +O2
2ZnO+2SO2;鼓风炉中:2C +O2 2CO
2CO
ZnO+CO Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2。

①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
⑵湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
知识点:化学与技术
⑴①2 mol·L-1(3分)② 180(2分) 6∶1(2分)
⑵①将烟道气净化,用于生产硫酸等(2分)②2Fe2+ +H2O2 +2H+ = 2Fe3+ +2H2O(2分)
③Cd2+ + 2OH-=Cd(OH)2↓(2分),Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-= Zn(OH)42-](2分)。
【化学——选修物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B元素原子的核外p电子数比s电子数少1
C原子的第一至第四电离能分别是:
I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol
D原子核外所有p轨道全满或半满
E元素的主族序数与周期数的差为4
F是前四周期中电负性最小的元素
G在周期表的第七列
(1)已知BA5 为离子化合物,写出其电子式 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
 (3)某同学根据上述信息,推断C基态原子的核外电子排布为,
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了 .
(4)G位于 族 区,价电子排布式为 .
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为 cm
知识点:物质的结构与性质
(1)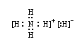 (2分) (2) 3 (2分),纺锤形(2分)
(2分) (2) 3 (2分),纺锤形(2分)
(3)泡利原理(1分) (4) 第ⅦB(1分) d (1分),3d54s2(1分)
(5) sp3(1分), 三角锥(1分) (6) 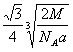 (3分)
(3分)
(选修5:有机化学基础)(15分)
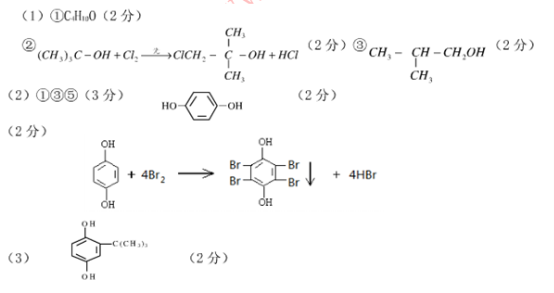
(1)饱和一元醇A是一种常见的有机溶剂,7.4g的A与足量金属Na反应放出1.12L的H2(标准状况下),且A可以发生以下变化:
已知:饱和一元醇中的烷基在光照的条件下可与氯气发生取代反应

①A分子式是
②A只有一种一氯取代物B,写出由A转化为B的化学方程式
③F是A的同分异构体,它也可以有框图内A的各种变化,且F分子中除官能团之外还有3种不同化学环境的氢原子,则F的结构简式是____________________
(2)有机物G(C6H6O2)可用作显影剂,遇含有Fe3+的溶液显紫色,G还能发生的反应是(选填序号)______
①加成反应 ②加聚反应 ③氧化反应 ④水解反应 ⑤酯化反应
G的一溴取代物只有一种,请写出G的结构简式:
请写出G与足量浓溴水反应的化学反应方程式:
(3)A和G在一定条件下相互作用形成水与一种食品抗氧化剂H,H与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物,请写出H的结构简式是:
知识点:有机化学知识综合应用