在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为 反应(选填“吸热”、“放热”).
(3)能说明该反应达到化学平衡状态的是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为 ℃.
(5)830℃时,在1L密闭容器中分别投入lmolH2和1molCO2反应达到化学平街时,CO2的转化率为 ;保持温度不变.在平衡体系中再充入1molH2和1molCO2重新达到化学平衡时,CO2的平衡转化率 (填“增大”“减小”或“不变”).
知识点:化学
(1)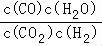 ;
;
(2)吸热;
(3)bc;
(4)700;
(5)50%;不变
【考点】化学平衡的计算.
【分析】(1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动;
(3)化学平衡状态的标志:正逆反应速率相等,各组分含量保持不变;
(4)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),则平衡常数K=0.6;
(5)结合平衡常数K=1和化学平衡三行计算列式得到,持温度不变.在平衡体系中再充入1molH2和1molCO2重新达到化学平衡相当于增大压强,反应前后气体物质的量不变,压强改变不改变平衡.
【解答】解:(1)CO2(g)+H2(g)⇌CO(g)+H2O(g)的化学平衡常数表达式K=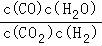 ,
,
故答案为: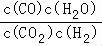 ;
;
(2)由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,则正反应是吸热反应,
故答案为:吸热;
(3)a.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b.混合气体中c(CO)不变,说明正逆反应速率相等,故b正确;
c.υ正(H2)=υ正(H2O)=υ逆(H2O),达平衡状态,故c正确;
d.平衡时,两者的浓度不变,而不一定相等,故d错误;
故答案为:bc;
(4)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),则平衡常数K=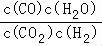 =0.6,所处温度为700℃,
=0.6,所处温度为700℃,
故答案为:700;
(5)反应前后气体物质的量不变,可以利用物质的量代替平衡浓度计算平衡常数,设二氧化碳消耗物质的量x,
CO2(g)+H2(g)⇌CO(g)+H2O(g),
起始量(mol) 1 1 0 0
变化量(mol) x x x x
平衡量(mol) 1﹣x 1﹣x x x
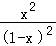 =1
=1
x=0.5
二氧化碳转化率=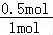 ×100%=50%,
×100%=50%,
保持温度不变.在平衡体系中再充入1molH2和1molCO2重新达到化学平衡相当于增大压强,反应前后气体物质的量不变,压强改变不改变平衡,CO2的平衡转化率不变,
故答案为:50%;不变.