常温下,将0.01molNH4Cl和0.005mol NaOH溶于水配成1L 溶液(pH>7).
(1)该溶液中存在的三个平衡体系是: 、 、 .
(2)溶液中存在的离子物质的量浓度由大到小顺序为 .
(3)这些粒子中浓度为0.01mol/L 的是 ,浓度为0.005mol/L 的是 .
(4)物质的量之和为0.01mol的两种粒子是: .
(5)NH4+和H+两种离子数量之和比OH﹣多 mol.
知识点:化学
(1)NH3•H2O⇌NH4++OH﹣; NH4++H2O⇌NH3•H2O+H+;H2O⇌H++OH﹣;
(2)c(Cl﹣)>c( NH4+)>c(Na+)>c(OH﹣)>c(H+);
(3)Cl﹣;Na+;
(4)NH4+、NH3•H2O;
(5)0.005
【考点】离子浓度大小的比较.
【分析】(1)常温下,将0.01molNH4Cl和0.005mol NaOH溶于水配成1L 溶液(pH>7),溶液中存在平衡为氯化铵和氢氧化钠反应生成的一水合氨电离平衡,剩余氯化铵溶液中铵根离子水解平衡,水的电离平衡;
(2)溶液中存在0.005molNH3•H2O、0.005molNH4Cl、0.005molNaCl,一水合氨电离程度大于铵根离子水解程度,据此判断溶液中离子浓度大小;
(3)溶液中存在0.005molNH3•H2O、0.005molNH4Cl、0.005molNaCl,溶液体积为1L,据此计算离子浓度;
(4)物质的量之和为0.01mol的两种粒子是一水合氨和铵根离子;
(5)电荷守恒计算分析;
【解答】解:(1)常温下,将0.01molNH4Cl和0.005mol NaOH溶于水配成1L 溶液(pH>7),溶液中存在平衡为氯化铵和氢氧化钠反应生成的一水合氨电离平衡,方程式为:NH3•H2O⇌NH4++OH﹣,剩余氯化铵溶液中铵根离子水解平衡,水解离子方程式为:NH4++H2O⇌NH3•H2O+H+,水的电离平衡,电离方程式为:H2O⇌H++OH﹣,
故答案为:NH3•H2O⇌NH4++OH﹣; NH4++H2O⇌NH3•H2O+H+;H2O⇌H++OH﹣;
(2)溶液中存在0.005molNH3•H2O、0.005molNH4Cl、0.005molNaCl,一水合氨电离程度大于铵根离子水解程度,离子浓度大小为:c(Cl﹣)>c( NH4+)>c(Na+)>c(OH﹣)>c(H+),
故答案为:c(Cl﹣)>c( NH4+)>c(Na+)>c(OH﹣)>c(H+);
(3)溶液中存在0.005molNH3•H2O、0.005molNH4Cl、0.005molNaCl,c(Cl﹣)=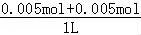 =0.1mol/L,c(Na+)=
=0.1mol/L,c(Na+)=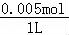 =0.005mol/L,c(NH4+)>0.005mol/L,这些粒子中浓度为0.01mol/L 的是Cl﹣,浓度为0.005mol/L 的是Na+,
=0.005mol/L,c(NH4+)>0.005mol/L,这些粒子中浓度为0.01mol/L 的是Cl﹣,浓度为0.005mol/L 的是Na+,
故答案为:Cl﹣;Na+;
(4)物料守恒可知,物质的量之和为0.01mol的两种粒子是一水合氨和铵根离子,
故答案为:NH4+、NH3•H2O;
(5)溶液中存在电荷守恒:c(Cl﹣)+c(OH﹣)=c( NH4+)+c(Na+)+c(H+),( NH4+)+c(H+)﹣c(OH﹣)=c(Cl﹣)﹣c(Na+)=0.1mol/L﹣0.005mol/L=0.005mol/L,1L溶液中NH4+和H+两种离子数量之和比OH﹣多0.005mol
故答案为:0.005;