化学与环境、材料和科技等密切相关。下列说法中错误的是
A.向煤中加入适量CaO可大大减少燃烧产物中SO2的量
B.光导纤维在信息产业中有广泛应用,制造光导纤维的主要材料是单质硅
C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情
D.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁
知识点:化学与社会的相互关系
略
关于下列图示的说法中正确的是

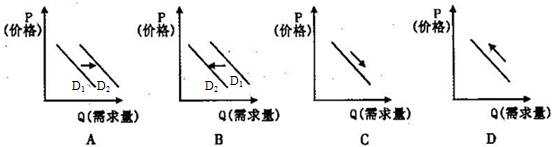
① ② ③ ④
A.图①装置用于分离沸点相差较大的互溶液体混合物
B.图②装置用于研究不同催化剂对反应速率的影响
C.图③表示可逆反应CO(g)
+ H2O(g)![]() CO2(g) +H2 (g);△H>0
CO2(g) +H2 (g);△H>0
D.对反应:A(s) + 2B(g)![]() xC (g);根据图④可以求出x=2
xC (g);根据图④可以求出x=2
知识点:基本概念、基本理论的综合运用
略
设NA为阿伏加德罗常数。下列叙述中正确的是
A.常温常压下 ,3.4gNH3中含N—H键数目为0.6NA
B.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
C.15g甲基(—14CH3)所含的电子数为9NA
D.标准状况下,2.24L氯仿(CHCl3)中所含氯原子数为0.3NA
知识点:化学中常用计量
略
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Mg2+、Na+、SO42-、Cl— B.K+、CO32-、Cl—、NO3—
C.Na+、K+、NO3—、SO32— D.NH4+、Na+、SO42-、NO3—
知识点:离子共存
略
有Fe2+、NO3-、Fe3+、NH4+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
A.还原产物为NH4+ B.氧化剂与还原剂的物质的量之比为8:l
C.若有l mol NO3-参加反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe 2+ -e-=Fe 3+
知识点:氧化还原反应
略
下列判断中一定正确的是
A.若R2-和M+的电子层结构相同,则原子序数:M > R
B.若X、Y是同主族气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
C.若M、N是同主族非金属元素,且电子层数:M>N,则非金属性:M>N
D.若X、Y属于同周期元素, 且原子序数:X>Y,则最高正价:X>Y
知识点:元素周期律与元素周期表
略
右图是探究铜丝与过量浓硫酸的反应,
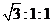
下列叙述不正确的是
A.上下移动①中铜丝可控制SO2的量
B.②中品红溶液褪色
C.③中石蕊溶液变红色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
知识点:综合性实验
略
在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.用50mL 12mol/L的氯化氢水溶液与足量二氧化锰共热制取氯气
B.向100mL 3mol/L的硝酸中加入5.6g铁
C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
D.在5×107Pa、500℃和铁触媒催化的条件下,1mol氮气和3mol氢气反应
知识点:物质的量的计算
略
通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是
A.CCl4中C—C1键键长比NC13中N—C1键键长短
B.NCl3分子中四个原子共平面
C.分子中的所有原子均达到8电子稳定结构
D.NBr3比NCl3易挥发
知识点:分子结构与性质
略
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
A.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池内部H+由正极向负极移动
知识点:原电池
略
在一固定体积的密闭容器中,进行下列化学反应: CO2(g) + H2(g) ![]() CO(g)
+ H2O(g) 其化学平衡常数K和温度T的关系如下表:则下列有关叙述不正确的是
CO(g)
+ H2O(g) 其化学平衡常数K和温度T的关系如下表:则下列有关叙述不正确的是
T(℃)
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
A.该反应为放热反应
B.可测量容器总压变化来判定化学反应是否达到平衡
C.若在某平衡状态时,c(CO2)×c(H2 )= c(CO)×c(H2O),此时的温度为830℃
D.若平衡时两种反应物的转化率相等,则起始投入时n(CO2):n(H2)=1:1
知识点:化学平衡状态及移动
略
叶蝉散(isoprocard)对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长。工业上用邻异丙基苯酚合成叶蝉散的过程如下:
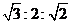
邻异丙基苯酚 叶蝉散
下列有关说法正确的是
A.叶蝉散的分子式是C11H16NO2 B.该过程为取代反应
C.叶蝉散在强酸、强碱性环境中能稳定存在
D.可用FeCl3检验叶蝉散中是否含邻异丙基苯酚
知识点:有机化学知识综合应用
略
现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为
A.1.0g B.2.0g C.2.5g D.3.5g
知识点:化学计算的综合运用
略
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
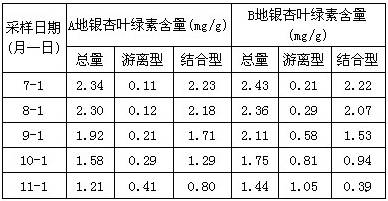
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
知识点:离子反应
略
反应N2O4(g)![]() 2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
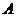
下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
知识点:化学平衡状态及移动
略
向氯酸钠的酸性水溶液中通入二氧化硫,反应中氧化过程为:SO2+2H2 O–2 e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- → 2Cl-。在上述两个反应中均会生成产物X,则X的化学式为
A.NaClO B.NaClO4 C.HClO D.ClO2
知识点:氧族元素
略
(13分) A、B、C、D、E是周期表短周期的五种常见元素,原子序数依次增大。C、D、E最高价氧化物对应的水化物两两均可以相互反应生成盐和水; A的原子序数与C的最外层电子数相同:B的氢化物水溶液显碱性;E的氢化物水溶液为强酸。回答下列问题:
(1) C在周期表中的位置是 ,写出其有色氧化物的一种用途
(2) B单质的结构式为 ,写出其氢化物的电子式
(3) B、E的氢化物混合时的现象为 ,生成物中含有的化学键有
(4) C、 D最高价氧化物对应的水化物相互反应的离子方程式为
(5) E的单质与A的一种氧化物反应生成具有漂白性的物质;E的单质与A的另一种氧化物
能发生置换反应。有关反应的化学方程式分别为:
;
知识点:元素周期律与元素周期表
略
(16分)相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
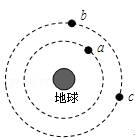
已知:www.ks5u.com
Ⅰ ![]() Ⅱ
Ⅱ

(苯胺,易被氧化)
(1)A、H的结构简式分别是 、
(2)反应②、③的类型分别是 、
(3)B、E反应的化学方程式是
(4)1mol阿司匹林最多消耗 mol NaOH;
(5)有多种同分异构体,其中符合下列条件的共有 种
①能发生银镜反应但不能水解
②每摩尔同分异构体最多消耗2mol NaOH
③苯环上一氯代物只有两种
(6)请用合成反应流程图表示出由A和其他无机物合成![]() 最合理的方案(不超过四步)
最合理的方案(不超过四步)
例:![]()
知识点:有机化学知识综合应用
略
(13分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶
液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
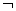
(3)装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是
(用化学方程式表示)
(5)为确认Q的存在,需在装置中添加M于 (选填序号)
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是
知识点:综合性实验
略