将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是
A.碘酒、盐酸、烧碱、硫酸钡 B.水银、硫酸、烧碱、蓝矾
C.氧气、硝酸、纯碱、胆矾 D.铁、醋酸、石灰水、氯化铜.
知识点:物质的分类
B
略
下列图示的四种实验操作名称从左到右依次是( )

A.过滤、蒸发、蒸馏、分液 B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液 D.分液、蒸馏、蒸发、过滤
知识点:仪器和基本操作
A
略
下列叙述正确的是
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1mol任何物质体积均为22.4L
知识点:物质的量
C
略
成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是( )
A. 木已成舟 B. 铁杵成针 C. 蜡炬成灰 D. 滴水成冰
知识点:氧化还原反应
C
略
溶液、胶体和浊液这三种分散系的本质区别是
A.能否透过滤纸或半透膜 B.能否发生丁达尔效应
C.是否均一、透明、稳定 D.分散质粒子直径的大小
知识点:分散系
D
略
实验室中需要配制1mol/L的NaOH溶液220mL,配制时应选用的容量瓶的规格和称取的NaOH质量分别是
A.220mL, 8.8g B.500mL,20 g
C.250mL,10 g D.任意规格,8.8g
知识点:仪器和基本操作
C
略
下列实验操作中错误的是 ( )
A.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
D.向沸腾的蒸馏水中逐滴加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热可得到Fe(OH)3胶体
知识点:仪器和基本操作
C
略
关于同温同压下同体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子个数相等。其中正确的是
A.①②③④ B.②③④ C.③④ D.③
知识点:阿弗加德罗定律
C
略
下列化学方程式中,不能用离子方程式Ba2+ + SO42— = BaSO4↓表示的是( )
A.Ba(NO3)2 +H2SO4= BaSO4↓+2HNO3 B.BaCl2+ Na2SO4= BaSO4↓+2 NaCl
C.BaCO3 + H2SO4= BaSO4↓+ H2O+CO2↑ D.BaCl2+ H2SO4= BaSO4↓+2HCl
知识点:离子方程式
C
略
下列说法正确的是( )
A.能电离出H+的化合物叫做酸
B.实验测得1mol某气体体积为22.4L,测定条件一定是标准状况
C.摩尔是七个基本物理量之一
D.化合物分为酸、碱、盐和氧化物是用树状分类法分类的
知识点:基本概念、基本理论的综合运用
D
略
下列溶液与20mL 1 mol·L—1 NaNO3溶液中NO3—物质的量浓度相等的是( )
A.10 mL 1 mol·L—1 Mg(NO3)2溶液 B.5 mL 0.8 mol·L—1 Al(NO3)3溶液
C.10 mL 2 mol·L—1 AgNO3溶液 D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液
知识点:溶液浓度的计算
D
略
对于反应:2H2S+SO2===3S +2H2O,被氧化的硫原子与被还原的硫原子的质量之比为( )
A.1:1 B.2:1 C.3:1 D.1:2
知识点:氧化还原反应
B
略
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 ( )
A.Na+ K+ OH- Cl-- B.Na+ Cu2+ SO42-- NO3--
C.Ca2+ HCO3-- NO3-- K+ D.Mg2+ Na+ SO42- Cl-
知识点:离子共存
D
略
下列反应的离子方程式中,正确的是( )
A.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
B.稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-= H2O +BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
知识点:离子反应
D
略
11分)实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是_____ _____。

A B C D E
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1mol/L(填“大于”“小于”或“等于”)。
(4)配制硫酸溶液过程中,下列操作会引起结果偏高的是 (填序号)
①未洗涤烧杯、玻璃棒
②未冷却至室温就转移到容量瓶定容
③容量瓶不干燥,含有少量蒸馏水
知识点:仪器和基本操作
(11分)(1)B、D(2分,各1分) 玻璃棒、500mL容量瓶(2分,各1分)
(2) B、C(2分,各1分)
(3)2.0(2分) 小于(1分)
(4) ②(2分)
略
(9分)除去括号中杂质,写出所加试剂与反应的离子方程式。
⑴SO42-(CO32-),所加试剂:_________,离子方程式:___________________________。
⑵Cl-(SO42-),所加试剂:_________,离子方程式:___________________________。
⑶Fe2+(Cu2+),所加试剂:_________,离子方程式:___________________________。
知识点:离子方程式
(9分)
⑴H2SO4 (1分) CO32-+2H+=CO2↑+H2O;(2分)
⑵ BaCl2 (1分) SO42-+Ba2+=BaSO4↓(2分)
⑶Fe(1分) Fe+Cu2+=Fe+Cu2+(2分)
略
(11分) (1) 下列物质中:①NaCl溶液 ②氢氧化钠 ③二氧化碳 ④金刚石 ⑤水 ⑥酒精,属于电解质的是__________;非电解质的是_________。(请用序号填空)
(2)(5分) 在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ;质量之比为 ,密度之比为 。(3)若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是 g。
知识点:物质的量
(11分)(1)② ⑤ 、 ③⑥ (每空2分)。
(2) 1:1 ; 1:1 ; 5:3 ; 4:11 ; 4:11 (每空1分)
(3)M/NA(2分)
略
(10分)已知:Fe2O3+3CO2Fe+3CO2。
(1)标出该反应中电子转移的方向和数目。
(2)该反应中被还原的元素是 ,氧化剂是__________,还原剂是__________。
(3)在该反应中,若有2 mol电子发生转移,在标准状况下,可生成CO2的体积为__________。
知识点:氧化还原反应
(10分,每空2分)
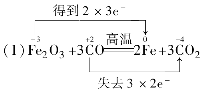
(2)氧化铁中的铁 Fe2O3 CO (3)22.4L
略