下列有关金属及其化合物的说法正确的是
A.Mg和Al都可以用电解法冶炼得到
B.Na2O和Na2O2与CO2反应产物完全相同
C.MgO和Al2O3均只能与酸反应,不能与碱反应
D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱
知识点:镁铝及其化合物
A
略
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的组合是
①碳酸钡难溶于水和酸,可做X光透视肠胃的药剂
②明矾净水利用了胶体的性质
③纯净的二氧化硅是现代光学及光纤制品的基本材料
④向煤中加入适量的石灰石,可以大大减少燃烧产物中SO2的含量
A.①②③④ B.①②③ C.①②④ D.②③④
知识点:化学与生活
D
略
已知下列数据:
Fe(s)+O2(g) =FeO(s) △H=-272kJ·mol-1
2Al(s)+O2(g) =Al2O3(s) △H=-1675kJ·mol-1
则2Al(s) +3FeO(s) =Al2O3(s) + 3Fe(s)的△H是
A.+859 kJ·mol-1 B.-2491 kJ·mol-1
C.-1403 kJ·mol-1 D.-859 kJ·mol-1
知识点:化学反应与能量
D
略
下列说法正确的是
A.乙烯和苯都能使酸性KMnO4溶液褪色
B.由CH2=CH-COOCH3合成的聚合物为![]() CH2-CH-COOCH3
CH2-CH-COOCH3![]() n
n
C.淀粉、蛋白质和油脂都能发生水解反应
D.棉花、蚕丝、人造羊毛的主要成分都是纤维素
知识点:生命中的基础有机化学物质
C
略
下列各组离子一定能大量共存的是
A.在无色溶液中: NH4+、Ag+、NO3—、MnO4—、I—
B.在pH=12的溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=0.1 mol·L-1的溶液中:Ca2+、Fe2+、ClO-、Cl-
D.由水电离出的c(H+)=1×10—13mol·L—1的溶液中:Mg2+、Al3+、HCO3-、SO42-
知识点:离子共存
B
略
下列离子方程式书写正确的是
A.用氯气作为水的消毒剂: Cl2+H2O = H++Cl-+HClO
B.+4价硫元素表现出还原性: H2SO3十2H2S==3S↓+3H2O
C.向AlCl3溶液中加入过量氨水: Al3+ + 4NH3•
H2O ![]() AlO2-+ 4NH4+ +
2H2O
AlO2-+ 4NH4+ +
2H2O
D. 澄清石灰水与过量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
知识点:离子方程式
A
略
下列叙述中,正确的是(已知:nA为阿伏伽德罗常数)
A.1 mol 氧化钠晶体中阴离子所带的负电荷数为6.02×1023
B.0.1mol·L-1 氯化铝溶液中含有Al3+数为 0.1 nA
C.常温常压下,71g氯气与足量氢氧化钠溶液反应转移的电子数为6.02×1023
D.标准状况下,44.8 L四氯化碳含有的分子数为2nA
知识点:物质的量的计算
C
略
关于常温下pH=3的醋酸溶液,下列叙述正确的是
A.加水稀释10倍后,pH=4
B.加水稀释后,溶液中c(H+)和c(OH-)均减少
C.加入醋酸钠晶体后,溶液的pH增大
D.加入等体积、pH=11的NaOH溶液后,c(Na+)= c(CH3COO-)
知识点:电解质溶液
C
略
.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)
下列叙述错误的是
CH3CH2OH(g)+3H2O(g)
下列叙述错误的是
A.反应需在300℃进行可推测该反应是吸热反应
B.使用Cu-Zn-Fe催化剂可大大提高生产效率
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
知识点:化学反应速率和化学平衡
B
略
下列叙述不正确的是
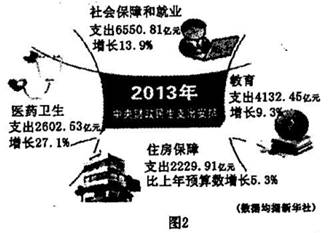
A.可用装置①制备NH3 B.可用装置②证明氨气极易溶于水
C.可用装置③从海水中得到淡水 D.可用装置④把胶体从溶液中分离出来
知识点:综合性实验
D
略
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是
A、将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性
B、将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D、将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
知识点:镁铝及其化合物
B
略
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。
已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
A. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI ![]() CeI4 + 2H2↑
CeI4 + 2H2↑
B. 四种稳定的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同系物
C. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+ == Ce3+ + Fe3+
D. 用惰性电极电解Ce(SO4)2溶液,在阴极可以获得铈单质
知识点:元素及其化合物的综合运用
C
略
下列试验现象预测正确的是
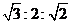
A、实验I:振荡后静置,上层溶液颜色保持不变
B、实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C、实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D、实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
知识点:综合性实验
BD
略
下列有关实验操作的叙述正确的是
A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度
B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧
C.向含有少量Ca(OH)2的Mg(OH)2悬浊液中加入饱和MgCl2溶液,充分搅拌后过滤,洗涤, 可
达到除去Mg(OH)2中的少量Ca(OH)2的目的
D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
知识点:化学实验
AC
略
、某小组为研究电化学原理,设计如图2装置。下列叙述正确的是
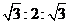
A、a和b不连接时,铁片上会有金属铜析出
B、a和b用导线连接时,铜片上发生的反应为:2H++2e-= H2↑
C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D、a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
知识点:电化学基础
AC
略
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
知识点:元素周期律与元素周期表
AD
略
(12分)惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
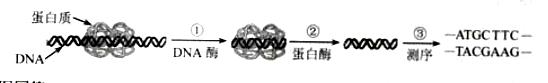
试回答下列问题:
(1)A的结构简式为 ,1 mol A物质完全燃烧需消耗_______mol O2 ;
(2)反应②的反应条件是 ;
(3)反应⑤的反应类型是 ,反应⑦的反应类型是 ;
(4)反应③的化学方程式为 ;
(5)下列关于D的说法正确的是
A.能与Br2的四氯化碳溶液反应 B.一定条件下能发生消去反应
C.与乙酸互为同系物 D.能与NaHCO3溶液反应
知识点:有机合成及高分子化合物
(12分)
(1) ![]() (2分)
, 7.5 (2分)
;
(2分)
, 7.5 (2分)
;
(2)氢氧化钠水溶液 ,加热 (2分);
 (3)消去反应(1分),酯化反应或取代反应(1分);
(3)消去反应(1分),酯化反应或取代反应(1分);
(4)
(2分)(缺条件,没配平共扣1分)
(5) AD (2分)(选1个且正确得1分,多选得0分)。
略
(12分)
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
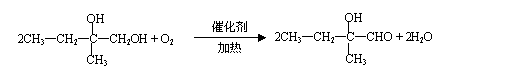
(1) 将0.050 molSO2(g)和0.030 molO2(g)放入容积为1L的密闭容器中,反应:
![]() 2SO2(g) + O2(g)
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(带单位计算并写出计算过程)。
2SO2(g) + O2(g)
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(带单位计算并写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列
措施中有利于提高SO2平衡转化率的有 (填字母)
A、升高温度 B、降低温度 C、增大压强
D、减小压强 E、加入催化剂 G、移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需
保持溶液足够酸性,其原因是 。
知识点:化学反应速率和化学平衡
![]() (1)
2SO2(g) + O2(g)
2SO3(g)
(1)
2SO2(g) + O2(g)
2SO3(g)
初始(mol/L) 0.05 0.03 0
变化(mol/L) 0.04 0.02 0.04
平衡时(mol/L) 0.01 0.01 0.04
 |
(2) BC
(3) H2O+SO2+Na2SO3= 2NaHSO3
(4)
![]()
![]() Fe2+ +2H2O
Fe(OH)2 +2H+, Fe3+ +3H2O Fe(OH)3 +3H+,C(H+)大,水解平衡向左移动,抑制了Fe2+、
Fe3+的水解,同时防止Fe2+被氧化。
Fe2+ +2H2O
Fe(OH)2 +2H+, Fe3+ +3H2O Fe(OH)3 +3H+,C(H+)大,水解平衡向左移动,抑制了Fe2+、
Fe3+的水解,同时防止Fe2+被氧化。
略
(12分). 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
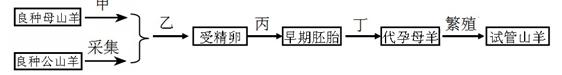
(1)图中D装置在实验中的作用是 .
(2)若 A为30% H2O2溶液,B为MnO2 ,C盛有氢硫酸
(H2S)饱和溶液,旋开E后,C中的现象为 ,
C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,
旋开E后,C中的现象是 ;继续通气体于C中,
足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液
中I2能被Cl2氧化为HIO3,写出该反应的化学方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有FeCl3溶液,旋开E,足够长的时间后,C中
发生反应的离子方程式为 。
知识点:综合性实验
(1)防止倒吸
(2)溶液变浑浊;2H2S+O2====2S↓+2H2O
(3)溶液变蓝色;I2+5Cl2+6H2O====2HIO3+10HCl
(4)有红褐色沉淀;Fe3++3NH3·H2O====Fe(OH)3↓+3NH4+
略
(12分). 我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量
堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3
约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴ 一种利用废弃赤泥的方法是:将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式 。
⑵ 为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:

已知:TiO2不溶于盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(其易水解生成TiO2·H2O沉淀)。
① 若将滤渣C与Al混合高温发生置换反应,其化学方程式为 ,
若有1mol滤渣C发生反应转移 mol电子。
② 原料A最好是下列物质中的 。
A.氨水 B.氢氧化钠 C.生石灰 D.双氧水
③ 写出上述工艺中投入氢氧化钠时反应的离子方程式 。
④ 写出上述工艺中稀释时发生水解反应的化学方程式 。
知识点:化学与技术
⑴ CaO+SO2=CaSO3 或Ca(OH)2+SO2=CaSO3+H2O
⑵ ① 3SiO2 +4 Al= 3Si + 2Al 2O3 4mol ② C
③ OH-+Al(OH)3=AlO2-+2 H2O
④ TiOSO4+2H2O=TiO2·H2O↓+H2SO4
略
(12分)硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂。Na2S2O3易溶于水,在酸性溶液中会迅速分解生成单质硫和二氧化硫,还具有较强的还原性。
(1)Na2S2O3溶液与足量氯水反应的离子方程式为________。(S元素被氧化为SO42-)
(2)硫代硫酸钠(Na2S2O3)露置在空气中易氧化变质,其可能的变质后生成物如下:
假设一:
假设二: 只有Na2SO4固体
假设三:
(3)现有一瓶Na2S2O3固体,可能混有Na2SO4固体。设计实验验证该假设,写出实验步骤、预期现象和结论。限选试剂: 1mol·L-1 H2SO4、1mol·L-1HNO3、1mol·L-1HCl、1mol·L-1NaOH、0. 1 mol·L-1BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
实验步骤
预期现象和结论
步骤1:取少量固体于试管中,加蒸馏水溶解。
步骤2:
步骤3:
知识点:氧化还原反应
(1)S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ (2分)
(2)假设一:只有Na2SO3
假设三:Na2SO4、Na2SO3都有(每空2分,共4分)
(3)(8分)
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量固体于试管中,加蒸馏水溶解。 |
|
|
步骤2:向试管中加入过量1 mol·L-1HCl溶液。充分振荡,静置。 |
有淡黄色沉淀生成。 |
|
步骤3:取上层清液于另一试管中,滴加少量0.1 mol·L-1BaCl2溶液。 |
有白色沉淀生成,证明固体中混有Na2SO4。 |
略