苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有 ( )
A.氧化性 B.还原性 C.碱性 D.酸性
知识点:氧化还原反应
B
略
用一种试剂就能将氯化钾、溴化钾、碘化钾三种无色溶液鉴别开来,此试剂是( )
A.溴水 B.NaOH溶液 C.硝酸钡溶液 D.硝酸银溶液
知识点:物质的检验和鉴别
D
略
下列各组关于强电解质、弱电解质、非电解质的归类正确的是 ( )
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H2CO3
Fe(OH)3
非电解质
蔗糖
BaSO4
C2H5OH
Na2O
知识点:物质的分类
C
略
下列说法正确的是 ( )
A.1mol氧为32g B.摩尔是物质的量的单位
C.44gCO2的体积为22.4L
D.2 mol·L-1的BaCl2溶液中含Cl-的个数为2.408×1024
知识点:物质的量
B
略
用特殊的方法把固体加工到纳米级(1~100nm,1nm=10-9m)超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同的数量级的是( )
A.溶液 B.悬浊液 C.胶体 D.乳浊液
知识点:分散系
C
略
VmLAl2(SO4)3溶液中含agSO42-,若把此溶液取一半加水稀释至2VmL,则稀释后溶液中Al3+的物质的量浓度为 ( )
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
知识点:溶液浓度的计算
D
略
下列有关氧化还原反应的叙述正确的是 ( )
A.肯定有一种元素被氧化,另一种元素被还原
B.在反应中所有元素的化合价都发生变化
C.任何一个置换反应一定属于氧化还原反应
D.化合反应和复分解反应不可能是氧化还原反应
知识点:氧化还原反应
C
略
锥形瓶配有玻璃导管的单孔塞,玻璃导管与大气相通,在瓶内玻璃管末端扎紧一个小气球如图所示。锥形瓶内收集满二氧化碳,迅速投入下列固体物质,立即塞紧,振荡,一段时间后,气球会自动膨胀的是 (
) 
A.Na2O B.Mg C.NaHCO3 D.NaOH
知识点:钠和碱金属
AD
略
决定气体体积的因素是 ( )
A.气体分子的直径
B.气体物质的量的多少
C.气体分子间的平均距离
D.气体分子的相对分子质量
知识点:阿弗加德罗定律
BC
略
鉴别Na2CO3和NaHCO3两种固体,不可以采用的方法是 ( )
A.溶于水,加石灰水
B.加热,将产生的气体通入澄清石灰水
C.配制成同物质的量浓度的溶液,测pH值
D.滴加同浓度的盐酸
知识点:钠和碱金属
A
略
下列有关0.2mol·L-1BaCl2溶液的说法不正确的是 ( )
A.500mL溶液中Cl-离子浓度为0.2 mol·L-1
B.500mL溶液中Ba2+离子浓度为0.2 mol·L-1
C.500mL溶液中Cl-离子总数为0.2NA
D.500mL溶液中Ba2+和Cl-离子总数为0.3NA
知识点:化学式的计算
A
略
在无色透明的强酸性溶液中能大量共存的离子组是 ( )
A.K+、Na+、NO3-、Cu2+ B.K+、Na十、Br-、Cu2+
C.Mg2+、Na+、Cl-、SO42- D.Na十、Ba2+、OH-、SO42-
知识点:离子共存
C
略
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶 ,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是 ( )
①浓H2SO4 ②NaOH溶液 ③KI溶液 ④饱和NaCl溶液

A.② B.②③ C.①②③ D.①②④
知识点:卤素
C
略
海带中含碘元素,有人设计如下步骤来提取碘:①通足量氯气②将海带烧成灰,向灰中加水搅拌③加入CCl4振荡④过滤⑤用分液漏斗分液。合理的操作顺序为 ( )
A.②一④一①一③一⑤ B.②一①一③一④一⑤
C.①一③一⑤一②一④ D.③一①一②一⑤一④
知识点:物质的分离、除杂和提纯
A
略
下列反应的离子方程式,书写正确的是 ( )
A.氢氧化钠与醋酸反应 OH- + H+ = H2O
B.碳酸钙溶于稀盐酸中 CaCO3+2H+ = Ca2++H2O+CO2
C.食盐水中滴加硝酸银溶液 Cl-+Ag+ = AgCl↓
D.氢氧化钡跟硫酸铜溶液反应 Ba2++SO42- = BaSO4↓
知识点:离子方程式
BC
略
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO![]() A.21∶5 B.11∶3 C.3∶1 D.4∶1
A.21∶5 B.11∶3 C.3∶1 D.4∶1
知识点:物质的量的计算
D
略
(4分)用于提纯或分离物质的方法有: A、萃取分液 B、加热分解 C、蒸发结晶 D、分液 E、蒸馏 F、过滤等,请将提纯或分离的序号填在后面横线上。
(1)分离饱和食盐水与泥沙的混合物
(2)分离水和汽油的混合物
(3)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物
(4)从碘水里提取碘
知识点:物质的分离、除杂和提纯
(4分)(1) F (2) D (3) E (4) A (每空1分)
略
(9分)实验室用氯化钠固体配制1.00mol·L-1的NaCl溶液500 mL,回答下列问题:
(1)请写出该实验的实验步骤
①计算,② ,③ ,④ ,⑤洗涤,⑥ ,⑦ 摇匀。
(2)所需仪器为:容量瓶(规格: )、托盘天平、还需要哪些玻璃仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响。(填空:A:偏高、B:偏低、C:无影响,填序号)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响 。
②定容时俯视容量瓶的标线。对所配溶液浓度的影响:
③ 配制前容量瓶用水洗涤后未进行干燥处理__________。
知识点:物质的制备
(9分)(1)②称量,③溶解,④移液,⑥定容
(2)规格: 500mL 烧杯、玻璃棒、胶头滴管 (写全得1分)。
略
(11分)下列各题中物质均由核电荷数为1—10的元素组成,按要求填写化学式。
(1)只有两个原子核和两个电子组成的分子是 。
(2)最外层分别为4个和6个电子的原子形成的化合物是 、 。
(3)最外层有6个电子的原子与氢原子结合所形成的化合物是 。
(4)由5个原子组成的电子总数为10的阳离子是 ,如何检验
;由2个原子组成的具有10个电子的分子有 ,阴离子有 。
(5)写出氟离子的原子结构示意图 。
(6)由三个最外层是6个电子的原子结合成的分子是 。
知识点:元素周期律与元素周期表

略
(10分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出实验室制备氯气以及工业上制取漂白粉的化学反应方程式,如果是氧化还原反应用双线桥法标出电子转移的方向和数目:
① ;
② 。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
(5)若将2 mol 氯气通入足量的石灰乳中,理论上可得到次氯酸钙 克。
(6)若工业上电解饱和食盐水制氯气过程中有20 mol电子发生转移,试计算理论上最多得到标准状况下的氯气的体积为 升。
知识点:电解池
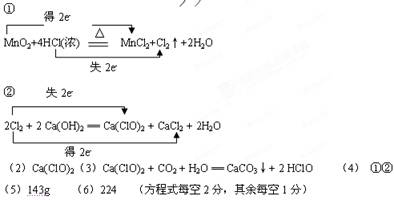
略
(6分)有一瓶澄清的溶液,其中可能含有K+、Na+、Ba2+、Mg2+、Fe3+、Cl—、CO32―、SO42―,取该溶液进行以下实验:
⑴ 取PH试纸检验,表明溶液呈强酸性,排除 离子的存在。
⑵ 另取部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则可排除 离子的存在。
⑶ 取上述碱性溶液滴加Na2CO3溶液,有白色沉淀生成,可排除 离子存在。
⑷ 根据以上实验事实确定:该溶液中肯定存在的离子是____________;
可能存在的离子是 。如需进一步确定,则可采用_________________方法。
知识点:物质的检验和鉴别
(6分)
(1) CO32― (2) Mg2+、Fe3+(3) SO42―(4) Ba2+、Cl;— K+、Na+焰色反应.(每空1分)
略
(6分)有一块锌片插入足量CuSO4溶液中,锌片质量减轻了0.1g,求:
(1)参加反应的锌的物质的量;
(2)析出铜的质量;
(3)反应中转移的电子个数。
知识点:物质的量的计算
(6分)(1)0.1mol 6.4g 1.204×1023 (每问2分)
略
(8分)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成,通过计算和推理回答下列问题:
(1)取A与足量的盐酸反应
① 若A的物质的量(nA)为定值,生成气体的量即为定值,则A的组成最多可能有___种。
② 若A的质量(mA)为定值,生成气体的量即为定值,则A的可能组成是____________;______________;_________________。(可以不填满,也可以补充)
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量澄清的石灰水,生成的沉淀均为10.0 g,则nA = ________ mol。
知识点:物质的量的计算
(8分)(1)6 2)MgCO3,NaHCO3; KHCO3,CaCO3 (3)0.2 (每空2分)
略