下列说法不正确的是
A、只有当碰撞的分子具有足够的能量和适当的取向时,才能发生化学变化
B、能发生有效碰撞的分子必须具有足够高的能量
C、无论是吸热反应还是放热反应,升高温度都能增大活化分子百分数
D、活化分子间的碰撞一定是有效碰撞
知识点:基本概念、基本理论的综合运用
D
略
已知在1×105 Pa,298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A.H2O(g) = H2(g) +
![]() O2 (g) △H = +242 kJ/mol
O2 (g) △H = +242 kJ/mol
B.2H2(g) + O2 (g) = 2H2O (l) △H = -484 kJ/mol
C.H2 (g) +
![]() O2 (g)
= H2O (l) △H = -242 kJ/mol
O2 (g)
= H2O (l) △H = -242 kJ/mol
D.2H2 (g) + O2 (g) = 2H2O (g) △H = +484 kJ/mol
知识点:化学反应的热效应
A
略
下列反应中,生成物的总能量大于反应物总能量的是
A.铝与稀盐酸反应 B.铁丝在氧气中燃烧
C.氢氧化钠与硝酸反应 D.焦炭在高温下与水蒸气反应
知识点:化学反应与能量的变化
D
略
一定温度下,对可逆反应A(g)+2B(g) ![]() 3C(g)的下列叙述,能说明反应已达到平衡的是
3C(g)的下列叙述,能说明反应已达到平衡的是
A、混合气体的物质的量不再变化ks5u
B、单位时间内消耗a mol A,同时生成3a mol C
C、容器内的压强不再变化
D、C生成的速率与C分解的速率相等
知识点:化学平衡状态及移动
D
略
对已经达到化学平衡的反应 2X(g)+ Y(g) ![]() 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
A、逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B、逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C、正、逆反应速率都减小,平衡向逆反应方向移动
D、正、逆反应速率都增大,平衡向正反应方向移动
知识点:化学反应速率
C
略
下列说法正确的是
A、多元弱的电离是分步进行的,多元弱酸的酸性强弱主要由第一步电离决定
B、中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸
C、将氢氧化钠溶液和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
D、强电解质溶液的导电能力一定比弱电解质溶液强
知识点:电解质溶液
A
略
下列各组热化学方程式中,△H1>△H2的是
① C(s)+O2(g)=CO2(g) △H1 ; C(s)+1/2O2(g)=CO(g) △H2
② S(s)+O2(g)=SO2(g) △H1 ; S(g)+O2(g)=SO2(g) △H2
③ H2(g)+1/2O2(g)=H2O(l) △H1 ; 2H2(g)+O2(g)=2H2O(l) △H2
④ CaCO3(s)=CaO(s)+CO2(g) △H1 ; CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.① B.④ C.②③④ D.①②③
知识点:化学反应的热效应
C
略
.已知: H+(aq)+OH-(aq)===H2O(l); △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为 ks5u
A、△H1==△H2>△H3 B、△H3>△H2>△H1
C、△H3>△H1>△H2 D、△H2>△H1>△H3
知识点:化学反应的热效应
C
略
有人预言:H2是21世纪最理想的能源,其根据不正确的是
A.生产H2的原料来源广阔 B. H2易液化,携带方便
C. 燃烧时无污染 D. 在等质量的可燃气体中,H2燃烧时放出的热量多
知识点:元素及其化合物的综合运用
B
略
常温下,分别将四块形状相同,质量均为9g的铁块同时投入下列四种溶液中,产生气体速率最快的是
A.200mL 2mol/L HCl B.500mL 2mol/L H2SO4
C.100mL 3mol/L HCl D.500mL 18.4mol/L H2SO4
知识点:化学反应速率
B
略
反应3A(g)+B(s)
![]() 2C(g)+D(g),在恒温、恒容条件下达到平衡的标志是
2C(g)+D(g),在恒温、恒容条件下达到平衡的标志是
A、混合气体的密度不再变 B、A、C、D的物质的量之比为3︰2︰1
C、容器内压强不再变 D、气体的物质的量不再变
知识点:化学平衡状态及移动
A
略
下列说法正确的是
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C.燃烧热或中和热是反应热的种类之一
D.在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
知识点:化学反应与能量的变化
C
略
下列说法正确的是
A.焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应
B.熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应
C.由焓判据和熵判据组合而成的复合判据,更适合于过程自发性的判断
D.焓减小的反应通常是自发的,因此不需要任何条件即可发生
知识点:化学反应与能量的变化
C
略
本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是:
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
知识点:化学反应速率和化学平衡
C
略
在一定条件下,将A2和B2两种气体通入密闭容器中,反应为:xA2+yB2 ![]() 2C,2s内的平均反应速率如下:v(A2)=0.5mol·L-1·s-1, v(B2)=1.5mol·L-1·s-1, v(C)=1mol·L-1·s-1,则x和y的值分别为
2C,2s内的平均反应速率如下:v(A2)=0.5mol·L-1·s-1, v(B2)=1.5mol·L-1·s-1, v(C)=1mol·L-1·s-1,则x和y的值分别为
A.2和3 B.1和3 C.3和2 D.3和1
知识点:化学反应速率和化学平衡的计算
B
略
下列关于能源和作为能源的物质叙述错误的是
A.化石能源物质内部蕴涵着大量的能量
B.绿色植物进行光合作用是,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同的条件下转为热能、电能为人类利用
D.吸热反应没有利用价值
知识点:化学与社会的相互关系
D
略
已知下列热化学方程式:Hg(l)+1/2O2(g)=HgO(s) △H =-90.7 kJ·mol-1
Zn(s)+1/2O2(g)=ZnO(s) △H =-351.1kJ·mol-1。
由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为
A.-260.4 kJ·mol-1 B.-441.8 kJ·mol-1
C.260.4 kJ·mol-1 D.441.8 kJ·mol-1
知识点:化学反应的热效应
A
略
右图是反应A2(g)+3B2(g)![]() 2C(g) △H<0
2C(g) △H<0
的平衡移动图,影响该反应平衡移动的原因是
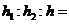
A.升高温度
B.增大反应物浓度
C.增大压强
D.使用催化剂
知识点:化学平衡状态及移动
C
略
在t℃时,向一密闭容器中放入1molA和1molB,发生下列反应,A(s)+B(g)![]() C(g)+2D(g)。平衡时C的含量为m%。若其他条件不变,要按下列配比将物质放入容器中,达到平衡时,C的含量仍为m%的是
C(g)+2D(g)。平衡时C的含量为m%。若其他条件不变,要按下列配比将物质放入容器中,达到平衡时,C的含量仍为m%的是
①3molA和1molB ②2molD和A,B,C各1mol ③1molC和2molD ④1molC和1molD
A.②③ B.①③ C.②④ D.③
知识点:化学平衡状态及移动
B
略
、在一密闭容器中,反应aA(g) ![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.物质A的转化率小了 B.平衡向正反应方向移动了
C.物质B的质量分数减小了 D.a>b
知识点:化学平衡状态及移动
B
略