室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.lmol.L﹣1的三种酸HA、HB和HD溶液,pH随NaOH溶液体积变化如图.下列说法不正确的是( )
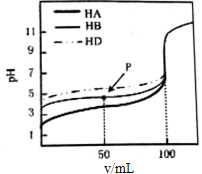
A.HA、HB和HD均为弱酸
B.P点时,c(B﹣)>c(Na+)>c(HB)>c(H+)>c(OH﹣)
C.pH=7时,三种溶液中:c(A﹣)=c(B﹣)=c(D﹣)
D.三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH﹣)﹣c(H+)
知识点:化学
C
【考点】酸碱混合时的定性判断及有关ph的计算.
【分析】A.常温下,0.1mol/L的一元酸如果pH=1,说明该酸完全电离,为强酸,如果pH>1,说明该酸部分电离,为弱酸;
B.根据图知,当加入100mLNaOH溶液时,酸碱恰好完全反应,则加入50mLNaOH溶液时,有一半的酸参加反应,则P点溶液中溶质为等物质的量浓度的c(HB)和c(NaB),混合溶液呈酸性,说明HB电离程度大于NaB水解程度导致溶液中c(H+)>c(OH﹣),根据电荷守恒知,c(B﹣)>c(Na+),弱酸部分电离;
C.常温下pH=7时溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得c(Na+)分别等于各酸根离子浓度,但各中性溶液中酸的酸性越强,消耗的碱体积越大;
D.任何电解质溶液中都存在质子守恒,根据质子守恒判断.
【解答】解:A.常温下,0.1mol/L的一元酸如果pH=1,说明该酸完全电离,为强酸,如果pH>1,说明该酸部分电离,为弱酸,根据图知,未加入碱溶液时这三种酸的pH都大于1,说明都部分电离,都是弱酸,故A正确;
B.根据图知,当加入100mLNaOH溶液时,酸碱恰好完全反应,则加入50mLNaOH溶液时,有一半的酸参加反应,则P点溶液中溶质为等物质的量浓度的c(HB)和c(NaB),混合溶液呈酸性,说明HB电离程度大于NaB水解程度导致溶液中c(H+)>c(OH﹣),根据电荷守恒知,c(B﹣)>c(Na+),弱酸部分电离,所以粒子浓度大小顺序是c(B﹣)>c(Na+)>c(HB)>c(H+)>c(OH﹣),故B正确;
C.常温下pH=7时溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得c(Na+)分别等于各酸根离子浓度,但各中性溶液中酸的酸性越强,消耗的碱体积越大,酸性强弱顺序是HA>HB>HD,所以各酸达到中性时需要碱体积HA>HB>HD,所以酸根离子浓度大小顺序是c(A﹣)>c(B﹣)>c(D﹣),故C错误;
D.任何电解质溶液中都存在质子守恒,各酸溶液中质子守恒为c(HA)+c(H+)=c(OH﹣)、c(HB)+c(H+)=c(OH﹣)、c(HC)+c(H+)=c(OH﹣),则三种溶液混合后得c(HA)+c(HB)+c(HD)═c(OH﹣)﹣c(H+),故D正确;
故选C.
【点评】本题考查酸碱混合溶液定性判断,为高频考点,正确判断酸性强弱是解本题关键,注意电荷守恒、质子守恒的灵活运用,易错选项是C,很多同学往往认为各酸溶液呈中性时钠离子浓度等于各酸根离子浓度而导致错误,为易错点.