某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
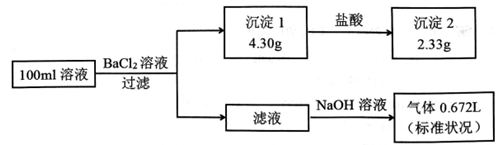
A.原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B.是否存在Na+只有通过焰色反应才能确定
C.原溶液一定存在Na+,可能存在Cl﹣
D.若原溶液中不存在Cl﹣,则c (Na+)=0.lmol•L﹣1
知识点:化学
B
【考点】无机物的推断;探究物质的组成或测量物质的含量.
【分析】加入氯化钡溶液,生成沉淀,一定含有碳酸根或是硫酸根中的至少一种,则该沉淀为BaSO4、BaCO3中的至少一种,沉淀部分溶解于盐酸,所以一定是BaSO4、BaCO3的混合物,一定存在CO32﹣、SO42﹣,硫酸钡沉淀是2.33g,物质的量是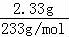 =0.01mol,碳酸根离子的物质的量是
=0.01mol,碳酸根离子的物质的量是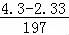 mol=0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是
mol=0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是 =0.03mol,钠离子和氯离子需要根据电荷守恒进行判断,以此解答该题.
=0.03mol,钠离子和氯离子需要根据电荷守恒进行判断,以此解答该题.
【解答】解:A.由以上分析可知原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+,故A正确;
B.阳离子所带正电荷的物质的量之和0.03mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,由电荷守恒可知一定含有钠离子,故B错误;
C.如钠离子的物质的量大于0.04mol﹣0.03mol=0.01mol(阴离子和阳离子电荷之差),则含有氯离子,故C正确;
D.已确定含有CO32﹣和SO42﹣、NH4+,且n(NH4+)=0.03moL、n(CO32﹣)=n(SO42﹣)=0.01mol,由电荷守恒可知n(Na+)=0.04mol﹣0.03mol=0.01mol,则浓度为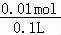 =0.1mol/L,故D正确.
=0.1mol/L,故D正确.
故选B,
【点评】本题考查无机物的推断,侧重常见阴阳离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.