化学与生产、生活密切相关,下列说法正确的是
A.小苏打用于治疗胃溃疡病人的胃酸过多症
B.电解从海水中得到的氯化钠溶液可获得金属钠
C.铝制容器不能盛放酸性或碱性食品,但可长期盛放腌制食品
D.FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路
知识点:化学与生活
D
略
下列关于化学用语的理解正确的是
A.HClO的电子式:![]() B.乙醛的结构简式为CH3CH2OH
B.乙醛的结构简式为CH3CH2OH
C.比例模型![]() 表示CH4分子或CCl4分子
D. Cl-离子的结构示意图:
表示CH4分子或CCl4分子
D. Cl-离子的结构示意图:![]()
知识点:化学用语
A
略
下列叙述中不正确的是
A.同素异形体的化学性质不一定相同 B.同位素原子的化学性质不一定相同
C.同系物的物质物理性质不一定相同 D.同分异构体的化学性质不一定相同
知识点:元素周期律与元素周期表
B
略
室温下,下列各组离子在指定溶液中能大量共存的是
A.饱和氯水中:C6H5O-、K+、SO42-、Br-
B.Na2S溶液中:SO42-、K+、Cl-、Cu2+
C.c(H+)=1.0×10―13mol·L―1溶液中:Cl-、NO3-、Na+、SO32-
D.水电离的c(H+)=1.0×10―13mol·L―1溶液中:NO3-、I-、Na+、Al3+
知识点:离子共存
C
略
下图所示为海水资源综合利用的一部分。下列有关说法不正确的是
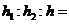
A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③、⑤中溴元素均被氧化
D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+ 等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
知识点:化学与技术
D
略
某无色溶液中可能含有Na+、NH4+、Fe3+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。下列说法错误的是
A.由①可确定肯定存在NH4+
B.由②可确定肯定不存在I-、S2-
C.SO42-、Ba2+是否存在无法确定
D.Fe3+肯定不存在,Na+是否存在可通过焰色反应确定
知识点:物质的检验和鉴别
C
略
下列有关实验原理、装置、操作或结论的描述中,正确的是
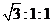
A.图①装置的烧杯中先出现白色沉淀后溶解
B.图②装置可验证氧化性:ClO—>Cl2>Fe3+
C.图③装置可用于实验室制备乙烯
D.图④装置可证明Na2CO3比NaHCO3更稳定
知识点:仪器和基本操作
B
略
下列离子方程式书写正确的是
A.向明矾溶液中加入过量的氢氧化钡溶液:
2Al3++3SO42-+6OH-+3Ba2+=2Al(OH)3↓+3BaSO4↓
B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
C.向碳酸氢铵溶液中加入足量的氢氧化钠溶液:
NH4++HCO3-+2OH-=CO32-+ NH3·H2O+H2O
D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+ OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
知识点:离子方程式
C
略
下列各组物质中,物质之间不能通过一步反应就能实现图示变化的是
选项
物质转化关系
a
b
c
d
A
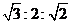
FeCl2
FeCl3
Fe
CuCl2
B
NO
NO2
N2
HNO3
C
Na2CO3
NaOH
Na2O2
NaHCO3
D
Al2O3
NaAlO2
Al
Al(OH)3
知识点:无机框图推断
B
略
一定条件下1 mol 白磷( P4 )与足量 NaOH 溶液反应,可制得2mol 该磷的含氧酸钠盐,同时得到68 g PH3。该磷的含氧酸钠盐的化学式为
A.NaH2PO2 B.NaH2PO3 C.Na2PO2、 D.Na3PO4
知识点:氮族元素
B
略
设NA表示阿伏加德罗常数,下列说法中正确的是
A.20 g D216O中含有的中子数目为10NA
B.标准状况下,使2.24 L水完全反应的钠原子为0.1NA
C.0.1 mol Na2O2晶体中含有的阴离子数目为0.2NA
D.0.1 mol Fe与足量水完全反应时失去的电子数为0.3NA
知识点:化学中常用计量
A
略
工业从铝土矿(主要成分是Al2O3·xH2O、SiO2、Fe2O3等)提取纯Al2O3再冶炼铝的过程如下图所示,下列有关不正确的是
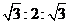
A.过滤、灼烧操作中都要用到玻璃棒
B.若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料
C.若Y为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3
D.图示所发生的反应类型有:分解反应、复分解反应、氧化还原反应
知识点:镁铝及其化合物
C
略
已知Fe3O4 可表示成(FeO· Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2+ +2S2O32-+O2+4OH-= Fe3O4 +S4O62-+2H2O。 下列说法不正确的是
A.用激光笔照射反应混合液有丁达尔现象
B.O2是氧化剂,S2O32-、Fe2+ 是还原剂
C.参加反应的氧化剂与还原剂的物质的量之比为1:5
D.若有2mol Fe2+ 参加反应,则被Fe2+还原的O2为0.5mol
知识点:氧化还原反应
CD
略
常温时0.1 mo1·L-1 NaHCO3溶液pH约为8,说明HCO3—水解强于电离。下列关系正确的是
A.c(Na+)>c(HCO3—)>c(OH—)>c(CO32—) B.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
C.c(Na+)>c(CO32—)>c(OH—)>c(H+) D.c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
知识点:盐类水解
AD
略
一定条件下铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。下列说法正确的是
FeO(s)+CO(g) △H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。下列说法正确的是
A.1100℃时,该反应的平衡常数K=2
B.达平衡时CO2的转化率为20%
C.5分钟内,CO2的平均反应速率v(CO2)=0.05mol/(L·min)
D.升高温度、增大压强、充入一定量CO2都能使平衡正向移动
知识点:化学平衡状态及移动
A
略
(16分)某兴趣小组用含铝、铁、铜的合金废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),方案如下:
⑴ 该方案需先配制一定物质的量浓度的烧碱、盐酸、硫酸溶液,且需进行多次过滤,上述操作中都需要用到的仪器有 ▲ ;从滤液C得到绿矾的操作是 ▲ 、过滤、洗涤。
⑵ 滤渣D制备胆矾有以下途径,其中最经济环保的是 ▲ 。
A.将D投入浓硝酸与稀硫酸的混酸 B.将D投入浓硫酸、加热
C.将D投入稀硫酸、加热同时通入空气 D.将D投入稀硫酸和H2O2的混合液中
⑶ ① 滤液A到沉淀E的过程中反应的离子方程式有 ▲ 、 ▲ 。
② 途径I和途径II中,你认为较合理的是 ▲ (填“途径I”或“途径II”)。
⑷ 取一小块上述合金投入30 mL的过量的稀盐酸中,待反应完全后过滤,往滤液里缓缓滴入1 mol·L-1的NaOH溶液,同时不断搅拌,生成沉淀与加入NaOH溶液的关系如图。
① 右图所示过程中铁元素参加反应的离子方程式为 ▲ 。
② 下列判断中不正确的是 ▲ 。
A.所用稀盐酸的物质的量浓度为1 mol·L-1
B.由图可以确定所取合金中铝的质量为0.27克
C.a越小,该合金中铁的质量分数越小,铜的质量分数越大
D.由图可以确定![]() 的取值范围为:0 <
a < 30
的取值范围为:0 <
a < 30
知识点:铁及其化合物
⑴ 烧杯、玻璃棒 蒸发浓缩、冷却结晶
⑵ C
⑶ ① OH-+CO2=2HCO3-
AlO2—+CO2+2H2O=Al(OH)3↓+HCO3-
② 途径Ⅱ
⑷ ① 4Fe2++8OH-+O2+2H2O=4Fe (OH)3↓
② AC
(每空2分,共16分)
略
(14分)室安卡因(G)是一种抗心律失常药物,可由下列路线合成:
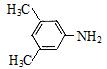
⑴ 已知A是![]() 的单体,则A中含有的官能团是 ▲ (写名称)。
的单体,则A中含有的官能团是 ▲ (写名称)。
⑵ C的名称(系统命名)是 ▲ ,C与足量NaOH醇溶液共热时反应的化学方程式是 ▲ 。
⑶ X是E的同分异构体,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有![]() 、
、![]() 、
▲ 、 ▲ 。
、
▲ 、 ▲ 。
⑷ F![]() G的反应类型是
▲ ;下列关于室安卡因(G)的说法不正确的是
▲ 。
G的反应类型是
▲ ;下列关于室安卡因(G)的说法不正确的是
▲ 。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d.属于氨基酸
知识点:有机合成及高分子化合物
⑴ 羧基、碳碳双键
⑵ 2-溴丙酸
![]() +2NaOH
+2NaOH![]() H2C=CHCOONa+NaBr+2H2O
H2C=CHCOONa+NaBr+2H2O
⑶ ![]()
⑷ 取代反应 d
(每空2分,共14分)
略
(14分)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图)。
请回答下列问题:
(1)NaOH溶液喷成雾状的目的是 ▲ 。
(2) ① 若用1.0 mol/L 800 mLNaOH溶液吸收标准状况下11.2 L的CO2,离子方程式为 ▲ 。
② Na2CO3溶液呈碱性的原因是(用离子方程式表示) ▲ 。
(3)① 以CO2与H2为原料可合成甲醇,甲醇碱性燃料电池的负极反应式为 ▲ 。
② 以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
2NH3(g)+ CO2(g)= NH2CO2NH4(s) △H = -159.47 kJ·mol-1
NH2CO2NH4(s)= CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
H2O(l)= H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式 ▲ 。
(4)一小块未被氧化的金属钠在CO2中加热,使其充分反应,得三种固体产物。
① 反应所得固体产物中n (Na)︰n (O) = 6︰7。
② 反应所得固体溶于水无气体产生,静置,有黑色固体析出;取上层清液加过量BaCl2溶液产生白色沉淀;再滴加酚酞,溶液呈红色。
则所得固体产物中化合物有 ▲ (写化学式);写出上述反应的化学方程式 ▲ 。
知识点:基本概念、基本理论的综合运用
(1)增大气液反应物的接触面积,既加速反应又提高CO2的吸收率
(2)① 5CO2+8OH-=2HCO3-+3CO32-+3H2O
② CO32—+H2O ![]() HCO3—+OH—
HCO3—+OH—
(3)① 2NH3(g)+ CO2(g)= CO(NH2)2(s)+H2O(l) △H =—130.98 kJ·mol-1
② CH3OH+8OH--6e- → CO32-+6H2O
(4)Na2O、Na2CO3 12Na+7CO2=2Na2O+4Na2CO3+3C
(每空2分,共14分)
略
(12分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
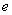
请回答下列问题:
⑴ 第①步加稀H2SO4时,粗MnO2样品中的 ▲ 。(写化学式)转化为可溶性物质。
⑵ 第②步反应的离子方程式是 ▲ 。
⑶ 第③步蒸发操作必需的仪器有铁架台(含铁圈)、 ▲ ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 ▲ 。(写化学式)。
⑷ 若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则MnCO3和MnO的物质的量依次为 ▲ ;在第②步反应中至少需要 ▲ mol NaClO3。(已知:Mr(MnCO3)=115,Mr(MnO2)=87,Mr(MnO)=71。)
知识点:物质的制备
⑴ MnO、MnCO3
⑵ 5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+
⑶ 酒精灯 蒸发皿 玻璃棒 NaCl
⑷ 0.01mol、0.04mol 0.02
(每空2分,共12分)
略
(12分)接触室中废钒催化剂含V2O5、VOSO4 和SiO2 等,从废钒催化剂中回收V2O5 的主要流程图如下:
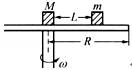
(1)反萃取过程使用质量浓度(单位体积溶液所含溶液的质量)为176.4 g/L的H2SO4,配制1 L该溶液需要质量分数为98%的浓硫酸 ▲ mL。(98%的浓硫酸的密度为1.8 g/cm3 )
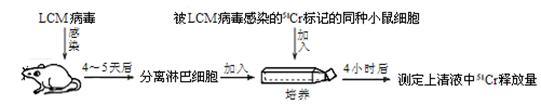
(2)某储能电池的原理如右图所示,溶液中c(H+) = 2.0 mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。充电过程中,a极的反应式为 ▲ 。
(3)浸取还原过程的产物为VOSO4,加入KClO3的反应为:KClO3 + VOSO4 + H2SO4 — KCl +
(VO)2(SO4 )3 + H2O(未配平)。若两步所用试剂Na2SO3与KClO3 物质的量之比为2: 1,则废钒催化剂中V2O5、VOSO4物质的量之比为 ▲ 。
(4)质谱法分析沉淀的摩尔质量为598g/mol,取沉淀59.8g充分焙烧,得固体残留物54.6 g,再将所得气体通入碱石灰,减少1.8g ,剩余气体能被稀硫酸完全吸收。通过计算确定沉淀的化学式。(已知:Mr(V2O5)=182。)
知识点:化学与技术
⑴ 176.4 g/L×1 L=V mL×1.8 g/cm3×98%,V=100。
⑵ VO2+ -e- + H2O = VO2+ + 2H+
⑶ 还原时的反应为:V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O;
氧化时的反应为:KClO3+6VOSO4+3H2SO4=3(VO)2(SO4)3+KCl+3H2O;
则废钒催化剂中n(V2O5)∶n(VOSO4)=2∶(1×6-2×2)=2∶2=1∶1。
(以上每空2分,共6分)
⑷ n(沉淀) =![]() mol=0.1
mol
(1分)
mol=0.1
mol
(1分)
n(V2O5)=![]() mol=0.3
mol
(1分)
mol=0.3
mol
(1分)
n(H2O)=![]() mol=0.1
mol
(1分)
mol=0.1
mol
(1分)
m(NH3)=59.8 g-54.6 g-1.8 g=3.4 g (1分)
n(NH3)=![]() mol=0.2
mol
(1分)
mol=0.2
mol
(1分)
故该沉淀的化学式为3 V2O5·2NH3·H2O,即V6N2H8O16 或 (NH4)2V6O16。 (1分)
(按步骤给分,共6分)
略
(12分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2 等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 ▲ 。
(2)写出一种与CO分子为等电子体的阴离子的电子式 ▲ 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2 的碱性溶液反应生成Cu2O 沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是 ▲ 。
甲醛分子中碳原子轨道的杂化类型为 ▲ 。
② 甲醛分子的空间构型是 ▲ 。1mol甲醛分子中σ键的数目为 ▲ 。
③ 在1个Cu2O 晶胞中(结构如图所示),所包含的Cu 原子数目为 ▲ 。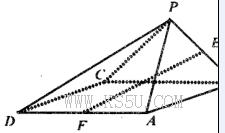
知识点:晶体结构与性质
(1)1s22s22p63s23p63d104s2 或 [Ar]3d104s2
(2) ![]() 或
或 ![]()
(3)① 甲醇分子之间形成氢键 sp2杂化
② 平面三角形 3NA
③ 4
(每空2分,共12分)
略