下列物质按纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是
A.纯盐酸、水煤气、硫酸、醋酸、干冰
B.冰醋酸、玻璃、硫酸钡、氢氟酸、乙醇
C.单甘油酯、冰水混合物、苛性钠、氢硫酸、三氧化硫
D.绿矾、漂白粉、次氯酸、氯化钾、氯气
知识点:基本概念、基本理论的综合运用
B
略
下列说法中正确的是
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应在恰当条件下才能实现
C.自发反应在任何条件下都能实现
D.自发反应一定是熵增大,非自发反应一定是熵减小或不变
知识点:基本概念、基本理论的综合运用
B
略
100 mL 6 mol·L-1H2SO4跟0.8 mol锌片反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量
A.硝酸钠固体B.硝酸钠溶液 C.6 mol·L-1硫酸氢钾溶液D.醋酸钠固体
知识点:氧族元素
D
略
为了使Na2CO3溶液中C(Na+)/C(CO32-)的比值变小,可适量加入
A.KOH溶液 B. 盐酸 C. NaOH 固体 D. NaOH溶液
知识点:盐类水解
A
略
下列各组微粒在指定条件下一定能大量共存的是
A.在pH=1的无色透明溶液中:NH4+、Na+、AlO2-、NO3-
B.同一个集气瓶中:N2、NO、NO2、O2
C.加入Al能放出H2的溶液中:Cl-、NO3-、Ba2+、Na+
D.常温下由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-18的溶液中:Cl-、NO3-、Ba2+、Na+
知识点:离子共存
D
略
下列所述的两个量,前者一定大于后者的是
A.水的离子积:25℃时,等体积且pH都等于3的AlCl3溶液和盐酸
B.沸点:NH3与PH3
C.pH值:分别用干燥的和润湿的pH试纸测同一试样
D.微粒数:含1molFeCl3的饱和溶液与水完全反应转化为氢氧化铁胶体后,其中胶粒的数目与32克氧气所含有的分子数
知识点:基本概念、基本理论的综合运用
B
略
下列离子方程式或化学方程式书写正确的是
A.2AlCl3(熔融)![]() 2Al + 3Cl2↑
2Al + 3Cl2↑
B.电解CuCl2溶液:2Cu2+ +2H2O 2Cu + 4H+ + O2↑
C.硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-![]() NH3↑+ 2H2O
NH3↑+ 2H2O
![]() D.Cu和AgNO3溶液反应:Cu+Ag+ Cu2++Ag
D.Cu和AgNO3溶液反应:Cu+Ag+ Cu2++Ag
知识点:离子方程式
C
略
下面能够构成原电池及电极反应式正确的是
![]() A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e- Fe2+
A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e- Fe2+
![]() B.Al、Cu、稀硫酸,负极反应式为:Cu-2e- Cu2+
B.Al、Cu、稀硫酸,负极反应式为:Cu-2e- Cu2+
![]() C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e- AlO2-+2H2O
C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e- AlO2-+2H2O
![]() D.Zn、Cu、乙醇,负极反应式为:Zn-2e- Zn2+
D.Zn、Cu、乙醇,负极反应式为:Zn-2e- Zn2+
知识点:原电池
C
略
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,正确的是
![]() A.电解饱和食盐水时,阳极的电极反应式为:2Cl—-2e— Cl2↑
A.电解饱和食盐水时,阳极的电极反应式为:2Cl—-2e— Cl2↑
![]() B.明矾净水时,主要反应的离子方程式为: Al3++3H2O Al(OH)3 ↓+3H+
B.明矾净水时,主要反应的离子方程式为: Al3++3H2O Al(OH)3 ↓+3H+
C.氢硫酸的电离方程式为:H2S ![]() 2H++S2—
2H++S2—
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e—![]() Fe2+
Fe2+
知识点:离子方程式
A
略
已知25℃时有关弱酸的电离平衡常数如下表:
弱酸化学式
HX
HY
H2CO3
电离平衡常数
7.8╳10-9
3.7╳10-15
K1=4.3╳10-7
K2=5.6╳10-11
下列推断正确的是
A.这两种弱酸的酸性HX>HY
B.相同条件下溶液的碱性NaX>Na2CO3>NaY>NaHCO3
C. 结合H+的能力:CO32->Y->X->HCO3-
D.HX和HY酸性相同,都比H2CO3弱
知识点:弱电解质的电离
A
略
在容积一定的密闭容器中发生可逆反应A(g)+2B(g)![]() 2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是
2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是
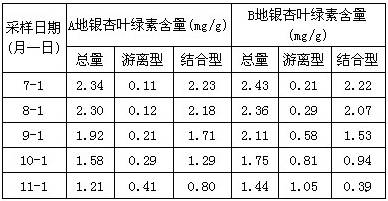
A.P1>P2,纵坐标指A的质量分数
B.P1> P2,纵坐标指C的质量分数
C.P1< P2,纵坐标指A的转化率
D.P1< P2,纵坐标指混合气体的平均摩尔质量
知识点:化学反应速率和化学平衡
B
略
.下列有关热化学方程式的评价合理的是
实验事实
热化学方程式
评价
A
已知H+(aq)+OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合
H2SO4(aq)+Ba(OH)2(aq)= BaSO4(s)+ 2H2O(l)
△H=-114.6 kJ·mol-1
正确
B
醋酸与稀氢氧化钠溶液混合
CH3COOH(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
△H=-57.3kJ·mol-1
不正确;因为醋酸状态为“aq”,而不是“l”。
C
160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ
SO3(g)+H2O(l)=H2SO4(aq) △H=-130.3 kJ·mol-1
不正确;因为反应热为△H=-260.6 kJ·mol-1
D
已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ
C(s)+O2(g)=CO2(g)
△H=-393.51 kJ·mol-1
不正确;同素异形体要注名称:C(石墨)
知识点:化学反应的热效应
D
略
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)构成一个原电池(如右图)。以下有关该原电池的叙述正确的是
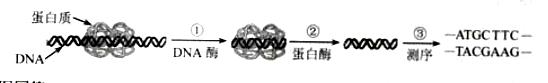
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
A.①② B.①②④
C.①②③ D.①②③④
知识点:原电池
B
略
14.常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如右图。下列说法正确的是
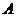
A. 点①所示溶液中:c(A-)+c(OH-) =c(HA) +c(H+)
B. 点②所示溶液中:c(Na+) = c(HA) +c(A-)
C. 点③所示溶液中:c(Na+) > c(A-)> c(OH-) > c(H+)
D. 滴定过程中可能出现:c(HA) > c(A-) > c(H+) > c(OH-)> c(Na+)
知识点:弱电解质的电离
C
略
在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,A的浓度变为原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,A的浓度变为原来的60%,则
A.平衡向正反应方向移动了 B.平衡向逆反应方向移动了
C.物质B的质量分数增加了 D.a<b
知识点:化学平衡状态及移动
B
略
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,平衡向右移动,B的平衡转化率增大
知识点:化学平衡状态及移动
B
略
已知25℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl 水溶液中加入盐酸,Ksp值变大
B.AgNO3 溶液与NaCl 溶液混合后的溶液中,一定有c(Ag+)=c( Cl— )
C.温度一定时,当溶液中c(Ag+)×c( Cl— )=Ksp,此溶液为氯化银的饱和溶液
D 将固体AgCl 加入到较浓的KI 溶液中,部分AgCl会转化为AgI ,所以 AgCl的溶解度小于AgI
知识点:溶解平衡
C
略
已知CO(g)十H2O(g)
![]() CO2(g)十H2 (g) △H<0 在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0molCO,3.0molH2O,1.0molCO2,5.0molH2,根据所学知识可知
CO2(g)十H2 (g) △H<0 在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0molCO,3.0molH2O,1.0molCO2,5.0molH2,根据所学知识可知
A. 此时反应向正反应方向进行
B. 平衡时CO2的物质的量为0.6mol
C.其他条件不变,向平衡后体系中加入1.0mol CO2,则平衡向左移动,K减小
D. 其他条件不变,向平衡后体系中再加入1.0molCO,3.0molH2O,1.0molCO2,5.0molH2,则平衡向左移动。
知识点:化学平衡状态及移动
D
略
(9分)(1)AgNO3的水溶液常温时的pH 7(填“>”、“=”、“<”),原因是: ____________________ (用离子方程式表示);实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度.以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):
_____________________ ,
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
知识点:电解质溶液
(离子方程式2分,其他每空1分,共9分)
(1)< ,Ag+ + H2O ![]() AgOH
+ H+ ,抑制 。
AgOH
+ H+ ,抑制 。
(2)酸,Al3++3H2O ![]() Al(OH)3+3H+, Al2O3 ;
Al(OH)3+3H+, Al2O3 ;
(3)NaOH。
略
(6分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- → 34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
知识点:原电池
(共9分)
(1)2C4H10+13O2=8CO2+10H2O(3分)
(2)O2+2CO2 +4e-→2CO32-(3分)
略
已知N2+3H2![]() 2NH3,根据下图判断:
2NH3,根据下图判断:
A是_____________的物质的量浓度变化情况。反应开始时,C(N2)=_____________ ;2min时C(NH3)=_____________________,
0-2min内氢气的平均反应速率v(H2)= ___________________。
(2)一定条件下,可逆反应A2+B2![]() 2C达到了化学平衡状态,经测得平衡时C(A2)=
0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
2C达到了化学平衡状态,经测得平衡时C(A2)=
0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
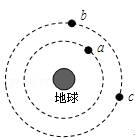
①a、b应满足的关系是______________。
②a的取值范围是________,说明理由___________________________。
知识点:化学反应速率和化学平衡
(每空2分,共12分)
(1) H2 4mol/L 1.5mol/(L·min)
(2)a- b= 0.4 0.4≤a≤1.3 略
略
(13分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
 (3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+ 浓度下降,这样,恰好完全反应时NH4+ 浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
知识点:电解质溶液
(共13分)
(1)碱式滴定管、烧杯、玻璃棒、100mL容量瓶、胶头滴管(5分)
(2)否(1分)
(3)①检查滴定管是否漏水(1分),用所要盛放的盐酸润洗2~3次(1分),“0”刻度或“0”刻度以下(1分);
②NH3.H2O +H+=NH4++H2O (1分);1.00mol/L(1分)
(4)不正确(1分),因为NH4+水解后,溶液中离子浓度保持不变(1分)。
略
(12分)(1)某化学小组的同学在学习了NaHCO3
和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:

① 试管中(填产生沉淀或气体及反应速率等相关现象)___________ _。
② 盛______________的试管中气球变得更大,大小气球体积之比约为(填简单整数比)____________;
③ 甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3
的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g); △H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g); △H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号
试剂1
试剂2
混合前温度
混合后最高或最低温度
①
35mL水
2.5g NaHCO3固体
20℃
18.5℃
②
35mL水
3.2g Na2CO3固体
20℃
24.3℃
③
35mL
稀盐酸
含2.5g NaHCO3的饱和溶液32.5mL
20℃
19℃
④
35mL
稀盐酸
含3.2g Na2CO3的饱和溶液23.1 mL+10ml水
20℃
24.2℃
⑤
35mL
稀盐酸
2.5gNaHCO3固体
20℃
16.2℃
⑥
35mL
稀盐酸
3.2g Na2CO3固体
20℃
25.1℃
请你帮助填写相关内容:
①该研究报告的题目是《_____________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论(用“吸热”或“放热”填写):
a:NaHCO3的溶解是_______过程;
b:Na2CO3的溶解是_______过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________反应;
e:NaHCO3固体与稀盐酸反应的反应热是______(填a、b、c、d中的字母)的热效应之和。
知识点:钠和碱金属
(每空1分,共12分)
(1)①碳酸氢钠放出气泡快
②碳酸氢钠 53:42
③不正确
(2)①关于碳酸氢钠与碳酸钠和盐酸反应热效应的研究
②温度计、托盘天平
吸热 放热 吸热 放热 a、c
略