生活中碰到的某些问题常常涉及到化学知识,下列分析正确的是
A.喝补铁剂时,加维生素C效果较好,因为维生素C具有氧化性
B.胃酸过多的人不宜吃海带、鸡肉、苹果等酸性食物
C.人造纤维、合成纤维和光导纤维都是有机高分子化合物
D.可用灼烧的方法来鉴别某白色纺织晶的成分是真蚕丝还是棉花
知识点:化学与生活
D
略
设NA是阿伏加德罗常数的值,下列说法正确的是
A.在32 g18O2中含有2NA个氧原子
B.1molCl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等
C.某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA
D.一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA
知识点:化学中常用计量
C
略
下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收)。关于这些装置的连接,下列说法正确的是

A.制备收集C2H4:连接a→d→f B.制备收集NO2:连接a→c→f
C.制备收集Cl2:连接a→d→e D.制备收集NH3:连接b→d→e
知识点:物质的制备
D
略
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:K+、Cl-、NH4+、AlO2-、SO42-
②常温下,pH=14的溶液中:CO32-、Na+、S2-、AlO2-
③室温下水电离的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
④加入Mg能放出H2的溶液中:NH4+、CI-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、Na+、Fe3+
⑥室温下c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、I-
A.①③⑥ B.①②⑤ C.②④⑤ D.①③④
知识点:离子共存
C
略
下列说法不正确的是
A.Y和Z均由元素R组成,反应Y+2I-+2H+=I2+Z+H2O,其中的R元素在地壳中 含量位居第一
B.F2、C2H4、Na2O2、C2H6、H2O2都是含有非极性键的共价化合物
C.锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+Li=LixV2O5。供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-=V2O5+xLi+
D.常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动
知识点:电解池
B
略
下列图像表达正确的是

A.图①表示25℃时,用0.1mol•L-1盐酸滴定20mL 0.lmol·L-1NaOH溶液
B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应
C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液
D.图④表示向盐酸和醋酸混合溶液中滴入氨水
知识点:水的电离和溶液的酸碱性
C
略
(17分)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)

请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式 。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用右图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。
③写出E与H2O反应的离子方程式,并标出电子转移情况 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则Vl和V2的关系为Vl V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 (写出一种情况即可)。
(2)若E为无色无味气体,F是二元弱酸。
①A的分子构型为正四面体,其电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物M,M的Ksp=8.1![]() 10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp
(填增大、减小或不变),此时,组成不溶物M的阴离子在溶液中的浓度为
mol/L。
10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp
(填增大、减小或不变),此时,组成不溶物M的阴离子在溶液中的浓度为
mol/L。
知识点:基本概念、基本理论的综合运用

略
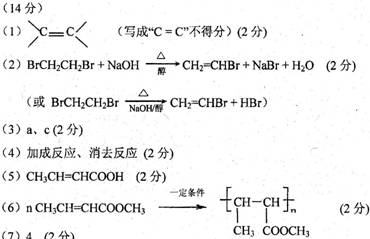
(14分)烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28。下图是以A为原料合成药物中间体E和树脂K的路线。

已知:I.
II.
(R、R’表示烃基或氢原子)
(1)A中宫能团的结构简式是 。
(2)B→C的化学方程式为 。
(3)E的分子式为C4H8O。下列关于E的说法正确的是 (填字母序号)。
a.能与金属钠反应
b.分子中4个碳原子一定共平面
c.一定条件下,能与浓氢溴酸反应
d.与CH2=CHCH2OCH2CH3互为同系物
(4)G→H涉及到的反应类型有 。
(5)I的分子式为C4H6O2,其结构简式为 。
(6)J→K的化学方程式为 。
(7)除E外,与E具有相同官能团的所有同分异构体还有 种(不考虑—OH连在双键碳上的结构)。
知识点:有机合成及高分子化合物
略
(18分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。

(1)制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热至l40oC时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持l40oC,此时烧瓶c中收集到无色液体。
①I和II是反应发生装置,应该选择 (选答“I”或“II”)与装置III相连。
②乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是 。
(2)III中水冷凝管的进水口是 (选答“a”或 “b”)。冰盐水的作用是 。
(3)有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号) 。

(4)反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中生成气体的两个化学反应方程式 ;
。
(5)实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:

①分液步骤除去产品中的酸性杂质,则X试剂可以是 。
②蒸馏操作可除去的杂质是 。
知识点:物质的制备

略
(15分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I.CH4(g)+H2O(g)===CO(g)+3H2(g) △H=+206.0 kJ•mol-1
II:CO(g)+2H2(g)==CH3OH(g) △H =-129.0 kJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如右图。

①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将amolCO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的最增加 D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4)若甲醇作为燃料电池的原料,KOH溶液为导电介质,则负极的电极反应式为
。
(5)甲醇对水质会造成一定的污染,有一种方法可消除这种污染,其原理是在酸性溶液中,用Co3+做氧化剂把水中的甲醇氧化成CO2而净化,Co3+被还原成Co2+。
①除去甲醇的离子反应方程式为 。
②若反应有12 mol e-转移,则可除去甲醇的质量为 g。
知识点:基本概念、基本理论的综合运用

略