下列关于有机物的用途,说法不正确的是
A.甲烷是一种热量高、污染小的清洁能源
B.乙烯最重要的用途是作为植物生长调节剂
C.乙醇是一种很好的溶剂,能溶解多种有机物和无机物
D.酯类物质常用作饮料、糖果、香水、化妆品中的香料
知识点:有机化学知识综合应用
B
下列说法正确的是
A.葡萄糖与淀粉互为同分异构体
B.糖类、油脂、蛋白质都是高分子化合物
C.糖类、油脂、蛋白质都能发生水解
D.油脂有油和脂肪之分,但都属于酯
知识点:生命中的基础有机化学物质
D
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
A.气态氢化物的稳定性:HX>H2Y>ZH3 B.非金属性:Y<X<Z
C.原子半径:X>Y>Z D.原子序数:Z>Y>X
知识点:化学
A
已知A、B两元素的原子序数在3~20之间,它们可形成离子化合物AmBn,若A的原子序数为a,则B的原子序数不可能为
A.a+8-m-n B.a-16-m-n C.a+16-m-n D.a-m-n
知识点:元素周期律与元素周期表
B
下列各组中的分子,全部是以极性键形成非极性分子的是
A.H2、N2、Cl2 B.CH4、NH3、H2O
C.HCl、NO、Br2 D.CO2、CS2、CCl4
知识点:化学键
D
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
知识点:元素周期律与元素周期表
B
下列关于右图所示原电池装置的叙述中,正确的是

A.铜片是负极
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
知识点:化学
D
反应4NH3+5O2 4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率表达正确的是
4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率表达正确的是
A.v(O2)=0.01mol L-1
L-1 s-1 B.v(NO)=0.008 mol
s-1 B.v(NO)=0.008 mol L-1
L-1 s-1
s-1
C.v(H2O)=0.003 mol L-1
L-1 s-1 D.v(NH3)=0.004 mol
s-1 D.v(NH3)=0.004 mol L-1
L-1 s-1
s-1
知识点:化学反应速率和化学平衡的计算
C
下面关于化学反应的限度的叙述中,正确的是
A.化学反应的限度都相同
B.可以通过改变温度控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,反应即停止
知识点:化学平衡状态及移动
B
现有①乙酸乙酯和乙酸钠溶液、②溴化钠溶液和溴水、③苯和溴苯的混合液,分离它们的正确方法依次是
A.分液、蒸馏、分液 B.萃取、分液、蒸馏
C.分液、萃取、蒸馏 D.蒸馏、分液、萃取
知识点:仪器和基本操作
C
苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使KMnO4(H+)溶液褪色;②苯分子中碳原子的距离均相等;③苯能在一定条件下跟H2加成生成环己烷;④经实验测得邻二甲苯仅一种结构;⑤苯在FeBr3存在条件下同液溴发生取代反应,但不因化学变化而使溴水褪色。
A.②③④⑤ B.①③④⑤ C.①②④⑤ D.①②③④
知识点:芳香烃 石油 苯 煤
C
能与Na反应放出H2,又能使溴水褪色,但不能使pH试纸变色的物质是
A.CH2=CH—COOH B.CH2=CH—CH2OH
C.CH2=CH—CH3 D.CH2=CH—COOCH3
知识点:有机化学知识综合应用
B
两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是
A.(1)(3)(4)(7)(8) B.(1)(2)(5)(7)(9) C.(1)(2)(5)(7)(9) D.(1)(2)(3)(4)(5)
知识点:基本概念、基本理论的综合运用
A
运用元素周期律分析下列推断,其中错误的是
A.铍是一种轻金属,它的氧化物的水化物可能具有两性
B.砹单质是一种有色固体,砹化氯很不稳定
C.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
D.硫酸锶难溶于水
知识点:元素周期律与元素周期表
C
下列递变情况中不正确的是
A.HF、HCl、HBr、HI的沸点依次升高
B.硅、磷、硫、氯元素的最高正化合价依次升高
C.O2-、F-、Na+、Mg2+的离子半径依次增大
D.锂、钠、钾、铷的金属性依次增强
知识点:元素周期律与元素周期表
A C
少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
知识点:化学
C
可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n molO2的同时生成2n mol NO2
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成n molO2的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的。比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②③⑤ C.①③④ D.①②③④⑤
知识点:化学反应速率和化学平衡
A
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2 2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH- ⑥该电池的电解质溶液可能是碱液。其中正确的是
2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH- ⑥该电池的电解质溶液可能是碱液。其中正确的是
A.①②⑥ B.②③④⑤ C.③ D.①③
知识点:原电池
D
0.5体积某气态烃只能与0.5体积氯气发生加成反应,生成氯代烷。0.5mol此氯代烷可与4 mol氯气发生完全的取代反应,则该烃的结构筒式为
A.CH2==CH2 B.CH3CH==CH2
C.CH3CH3 D.CH3CH2CH==CH2
知识点:烯烃
D
下列关于有机物的叙述中,不正确的是
A.烷烃的同系物的分子式可用通式CnH2n+2表示
B.互为同系物的有机物也互为同分异构体
C.两个同系物之间的相对分子质量差为14或14的整数倍
D.同分异构体间具有相似的化学性质
知识点:烷烃
B D
下列用水就能鉴别的一组物质是
A.苯、己烷、四氯化碳 B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳 D.硝基苯、乙醇、乙酸
知识点:有机化学知识综合应用
B
由乙炔(C2H2)、苯和甲醛(CH2O)组成的混和物中,测得含碳元素的质量百分含量为72%,则混和物中氧元素的质量百分含量为
A.20.7% B.22% C.24.9% D.28%
知识点:有机计算
A
下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族
周期
I A
IIA
IIIA
ⅣA
VA
ⅥA
ⅦA
0
二
①
②
③
三
④
⑤
⑥
⑦
⑧
四
⑨
⑩
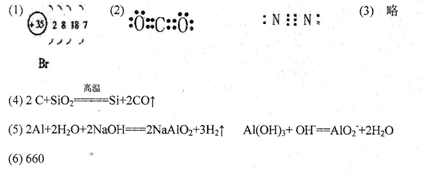
(1)在这些元素中,⑩原子的原子结构示意图为 。
(2)写出①的最高价氧化物和②的单质的电子式 , 。
(3)用电子式表示③与④形成化合物的过程 。
(4)①的单质和⑥的氧化物反应的化学方程式 。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出 kJ的热量。
知识点:元素周期律与元素周期表
A、X、Y、Z和W是原子序数依次增大的五种短周期元素。A和X可组成两种常温下为液态的化合物A2X、A2X2,X和Y也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色。在元素周期表中,A与Y同主族,X与Z同主族,Z与W相邻。请同答:
(1)A2X2的结构式 ,Y2X2的电子式 。
(2)X、Z两种元素的氢化物中熔沸点较高的是 (填化学式,下同);工业上将Z的低价氧化物转化为高价氧化物的化学方程式为 。
(3)W元素在周期表中的位置为 ;实验室制备W单质的化学反应方程式为 ;在上述反应中氧化剂和还原剂的物质的量比为 。
知识点:元素周期律与元素周期表
