己知有机物A是一种重要的化工原料,其在标准状况下的密度为1.25g/L.

(1)C中的官能团名称 ;⑥的反应类型 ;
(2)反应⑤的反应方程式为 ;
(3)下列说法正确的是 .
A.淀粉发生反应①后直接加银氨溶液可以检验D的生成
B.B、C、E可以用饱和碳酸钠溶液鉴别
C.反应⑥中浓硫酸的作用是催化剂和吸水剂
D.①和④的反应类型相同.
知识点:化学
(1)羟基;取代反应(或酯化反应);
(2)CH2=CH2+CH3COOH CH3COOCH2CH3;
CH3COOCH2CH3;
(3)BC
【考点】有机物的推断.
【分析】有机物A是一种重要的化工原料,其在标准状况下的密度为1.25g/L,则相对分子质量为22.4×1.25=28,应为CH2=CH2,淀粉水解生成的D为葡萄糖,C为CH3CH2OH,B为CH3COOH,E为CH3COOCH2CH3,以此解答该题.
【解答】解:(1)C为CH3CH2OH,含有的官能团为羟基,⑥为乙酸、乙醇的酯化反应,也为取代反应,故答案为:羟基;取代反应(或酯化反应);
(2)反应⑤易乙烯雨乙酸的反应,方程式为CH2=CH2+CH3COOH CH3COOCH2CH3,故答案为:CH2=CH2+CH3COOH
CH3COOCH2CH3,故答案为:CH2=CH2+CH3COOH CH3COOCH2CH3;
CH3COOCH2CH3;
(3)A.淀粉在酸性条件下水解生成葡萄糖,检验葡萄糖应在碱性条件下进行,故A错误;
B.B、C、E分别为乙酸、乙醇和乙酸乙酯,乙酸与碳酸钠反应生成气体,乙醇易溶于水,乙酸乙酯不溶于饱和碳酸钠溶液,则可以用饱和碳酸钠溶液鉴别,故B正确;
C.反应⑥为酯化反应,且为可逆反应,浓硫酸的作用是催化剂和吸水剂,故C正确;
D.①为水解反应,④为氧化反应,反应类型不相同,故D错误.
故答案为:BC.
【点评】本题考查有机物的推断,为高频考点,把握信息及官能团的变化为解答的关键,侧重分析与推断能力的考查,题目难度不大.
某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)写出红棕色固体C的化学式 .
(2)写出A受热分解反应的化学方程式 .
(3)写出检验A中阳离子的实验方案 .
知识点:化学
(1)Fe2O3;
(2)2FeSO4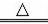 Fe2O3+SO3↑+SO2↑;
Fe2O3+SO3↑+SO2↑;
(3)取少量试样配成溶液'再滴入KSCN溶液不变色,再滴加少量氯水,出现血红色,证明有亚铁离子
【考点】探究物质的组成或测量物质的含量.
【分析】n(B)= =0.02mol,生成白色沉淀D为BaSO4,且n(BaSO4)=
=0.02mol,生成白色沉淀D为BaSO4,且n(BaSO4)=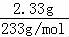 =0.01mol,说明n(SO3)=0.01mol,红综合固体为Fe2O3,n(Fe2O3)=
=0.01mol,说明n(SO3)=0.01mol,红综合固体为Fe2O3,n(Fe2O3)=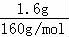 =0.01mol,说明A含有Fe、S、O等元素,B中还含有SO2,且n(SO2)=0.01mol,以此解答该题.
=0.01mol,说明A含有Fe、S、O等元素,B中还含有SO2,且n(SO2)=0.01mol,以此解答该题.
【解答】解:(1)由以上分析可知C为Fe2O3,故答案为:Fe2O3;
(2)由以上分析可知n(SO3)=0.01mol,n(SO2)=0.01mol,n(Fe2O3)=0.01mol,且m(SO3)+m(SO2)+m(Fe2O3)=0.01mol×80g/mol+0.01mol×64g/mol+1.6g=3.04g,说明A中n*Fe):n(S):n(O)=1:1:4,A为FeSO4,分解的方程式为2FeSO4 Fe2O3+SO3↑+SO2↑,
Fe2O3+SO3↑+SO2↑,
故答案为:2FeSO4 Fe2O3+SO3↑+SO2↑;
Fe2O3+SO3↑+SO2↑;
(3)检验亚铁离子,可取少量试样配成溶液'再滴入KSCN溶液不变色,再滴加少量氯水,出现血红色,证明有亚铁离子,
故答案为:取少量试样配成溶液'再滴入KSCN溶液不变色,再滴加少量氯水,出现血红色,证明有亚铁离子.
【点评】本题考查无机物的推断以及物质的组成的判断,为高频考点,把握二氧化硫的性质、铁离子检验为解答的关键,侧重分析与推断能力的考查,注意从质量守恒的角度判断A的化学式,题目难度不大.
欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.
(1)红热的炭与浓硫酸发生反应的实验装置如图,仪器a的名称为 ,在使用前需要检漏,检漏的方法是 .
(2)能证明红热的炭与浓硫酸反应产物中有CO2的实验现象为 .

知识点:化学
(1)分液漏斗;向分液漏斗中加入少量水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水;
(2)品红溶液2不褪色,澄清石灰水变浑浊
【考点】浓硫酸的性质实验.
【分析】(1)a为分液漏斗,检验是否漏水,可检验旋塞和玻璃塞;
(2)浓硫酸和二氧化碳反应生成二氧化硫和二氧化碳,二者都与石灰水反应,应先除去二氧化硫.
【解答】解:(1)由装置可知为分液漏斗,在使用前需要检漏,检漏的方法是,
故答案为:分液漏斗;向分液漏斗中加入少量水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水;
(2)浓硫酸和二氧化碳反应生成二氧化硫和二氧化碳,二者都与石灰水反应,应先除去二氧化硫,气体通过品红2后不褪色,通过石灰水变浑浊,才能证明气体中含有二氧化碳气体,
故答案为:品红溶液2不褪色,澄清石灰水变浑浊.
【点评】本题考查浓硫酸性质实验,侧重考查实验操作、分析能力,明确物质的性质是解本题关键,注意二氧化硫和二氧化碳都能使澄清石灰水变浑浊,难度不大.
Na与Al混合物共1mol与足量的水充分反应.(已知:2A1+2NaOH+2H2O═2NaAlO2+3H2↑)
(1)当Na与Al的物质的量之比为 时,混合物与水反应产生的H2最多.
(2)当Na与Al的物质的量之比为 时,混合物与水反应产生的H2的体积为13.44L(标准状况下).
知识点:化学
(1)1:1;
(2)9:1(或3:7)
【考点】化学方程式的有关计算.
【分析】(1)据方程式2A1+2NaOH+2H2O═2NaAlO2+3H2↑要想生成H2最多,则消耗铝最多来分析;
(2)分不同情况讨论金属铝有没有完全反应,并根据得失电子守恒计算.
【解答】解:(1)设Na为xmol,则Al为(1﹣x)mol
2Na+2H2O=2NaOH+H2↑①
2 2 1
x x 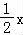
∵由方程式②可知消耗铝的物质的量越多生成H2的量越多,要想消耗铝最多,则反应①生成的NaOH需完全反应
∴2A1+2NaOH+2H2O═2NaAlO2+3H2↑②
2 2 3
x x 3x
则(1﹣x)=x,解得x=0.5
∴n(Na)=0.5mol,n(Al)=0.5mol
n(Na):n(Al)=0.5:0.5=1:1,故答案为:1:1;
(2)
情况一、Na与Al完全反应时,
n(H2)=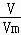 =
=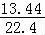 =0.6mol则得到电子数目为n(e﹣)=1.2mol
=0.6mol则得到电子数目为n(e﹣)=1.2mol
设参加反应的金属Naxmol,Alymol,则失去电子数为n(e﹣)=x+3y
根据得失电子守恒得:x+3y=1.2①
x+y=1②
联立①②解得x=0.9,y=0.1,n(Na):n(Al)=0.9:0.1=9:1
情况二、Al未完全反应时,设Naxmol,Al(1﹣x)mol.
2Na+2H2O=2NaOH+H2↑①
2 2 1
x x 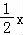
2A1+2NaOH+2H2O═2NaAlO2+3H2↑②
2 2 3
x x 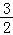 x
x
n(H2)=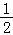 x+
x+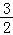 x=o.6,解得x=0.3mol即n(Na)=0.3mol
x=o.6,解得x=0.3mol即n(Na)=0.3mol
∴n(Al)=1﹣0.3=0.7mol则n(Na):n(Al)=3:7
故答案为:9:1(或3:7).
【点评】金属铝要想反应必须要金属钠反应生成氢氧化钠,故题目二要从两方面考虑,以及正确书写方程式也是解题的关键.
(10分)液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.
已知:2NH3(g) N2(g)+3H2(g)△H=92.4kJ•mol﹣1
N2(g)+3H2(g)△H=92.4kJ•mol﹣1
2H2(g)+O2 (g)=2H2O(g)△H=﹣483.6kJ•mol﹣1
NH3(1) NH3 (g)△H=23.4kJ•mol﹣1
NH3 (g)△H=23.4kJ•mol﹣1
(1)4NH3(1)+3O2 (g) 2N2(g)+6H2O(g) 的△H= ,该反应的平衡常数表达式为 .
2N2(g)+6H2O(g) 的△H= ,该反应的平衡常数表达式为 .
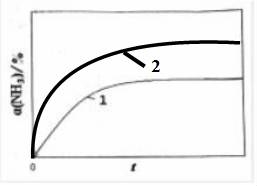
(2)2NH3(g) N2(g)+3H2(g)能白发进的条件是 (填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l.如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线(标注2).
N2(g)+3H2(g)能白发进的条件是 (填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l.如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线(标注2).
(3)有研究表明,在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,写出阴极的电极反应式 .
(4)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,用a、b表示NH3•H2O的电离平衡常数为 .

知识点:化学
(1)﹣1172.4kJ/mol;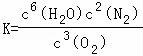
(2)高温,
 .
.
(3)N2+6H2O+6e﹣=2NH3+6OH﹣.
(4)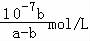
【考点】化学平衡的计算.
【分析】(1)所求的方程式4NH3(1)+3O2 (g)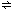 2N2(g)+6H2O(g)的焓变△H可由已知焓变的热化学方程式推导根据盖斯定律可计算该反应的焓变;对于以气相为主导的反应方程式,液相的浓度可忽略,平衡常数的表达式应将气相的浓度幂列入为主;
2N2(g)+6H2O(g)的焓变△H可由已知焓变的热化学方程式推导根据盖斯定律可计算该反应的焓变;对于以气相为主导的反应方程式,液相的浓度可忽略,平衡常数的表达式应将气相的浓度幂列入为主;
(2)反应2NH3(g)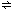 N2(g)+3H2(g),该反应为气体数增加的反应,可判断熵变△S>0,已知该反应的焓变△H>0,据此判断自发进行的条件;恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l.如果保持其他条件不变,将反应温度提高到T2,该反应的焓变△H>0,反应是吸热的反应,升高温度,化学反应速率加快,比原先更快达到平衡,且升高温度,NH3的转化率会升高,图象较图象1高度要高,据此画图;
N2(g)+3H2(g),该反应为气体数增加的反应,可判断熵变△S>0,已知该反应的焓变△H>0,据此判断自发进行的条件;恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l.如果保持其他条件不变,将反应温度提高到T2,该反应的焓变△H>0,反应是吸热的反应,升高温度,化学反应速率加快,比原先更快达到平衡,且升高温度,NH3的转化率会升高,图象较图象1高度要高,据此画图;
(3)研究表明,在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,注意是在碱性溶液中,要么是OH﹣参加反应,要么是反应生成OH﹣,电解池阴极是物质得到电子的反应,生成NH3,据此写出电极反应方程式;
(4)25℃时,amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,则溶液中存在c(H+)=c(OH﹣),二者反应生成NH4Cl,而NH4Cl水解会使溶液呈酸性,这里溶液显中性,可以判断氨水是稍过量的,根据反应关系和氨水的电离平衡常数表达是求解.
【解答】解:(1)①2NH3(g)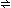 N2(g)+3H2(g)△H1=92.4kJ/mol,
N2(g)+3H2(g)△H1=92.4kJ/mol,
②2H2(g)+O2 (g)=2H2O(g)△H2=﹣483.6kJ/mol,
③NH3(1)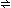 NH3 (g)△H3=23.4kJ/mol,
NH3 (g)△H3=23.4kJ/mol,
对于反应:4NH3(1)+3O2 (g)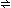 2N2(g)+6H2O(g),可由①×2+②×3+③×4可得,根据盖斯定律,该反应的焓变△H=2△H1+3△H2+4△H3=﹣1172.4kJ/mol;对于以气相为主导的反应方程式,液相的浓度可忽略,平衡常数的表达式应将气相的浓度幂列入为主,则该反应的平衡常数表达式应为:
2N2(g)+6H2O(g),可由①×2+②×3+③×4可得,根据盖斯定律,该反应的焓变△H=2△H1+3△H2+4△H3=﹣1172.4kJ/mol;对于以气相为主导的反应方程式,液相的浓度可忽略,平衡常数的表达式应将气相的浓度幂列入为主,则该反应的平衡常数表达式应为: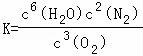 .
.
故答案为:﹣1172.4kJ/mol;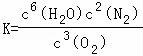 .
.
(2)反应2NH3(g)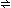 N2(g)+3H2(g),该反应为气体数增加的反应,体系混乱度增加,则反应的熵变△S>0,已知该反应的焓变△H>0,因此该反应能自发进行的条件是高温;恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l,保持其他条件不变,将反应温度提高到T2,由于已知该反应的焓变△H>0,表明反应是吸热的反应,升高温度,不仅能加快反应速率,导致平衡的拐点过早出现,且能促使化学反应向正反应方向移动,导致反应物NH3的转化率比原先的要高,据此,图象2应在图象1的上方,据此作图为:
N2(g)+3H2(g),该反应为气体数增加的反应,体系混乱度增加,则反应的熵变△S>0,已知该反应的焓变△H>0,因此该反应能自发进行的条件是高温;恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线l,保持其他条件不变,将反应温度提高到T2,由于已知该反应的焓变△H>0,表明反应是吸热的反应,升高温度,不仅能加快反应速率,导致平衡的拐点过早出现,且能促使化学反应向正反应方向移动,导致反应物NH3的转化率比原先的要高,据此,图象2应在图象1的上方,据此作图为:
 .
.
故答案为:高温,
 .
.
(3)在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,反应在碱性介质中进行,可能是反应物中OH﹣参与反应,也可能是生成物中产生OH﹣,由于在阴极发生的反应,电解池中阴极是物质得到单子,考虑到溶液中的电荷守恒,因此是反应物中产生OH﹣,这里N元素化合价降低,在阴极处发生的电极反应应为:N2+6H2O+6e﹣=2NH3+6OH﹣.
故答案为:N2+6H2O+6e﹣=2NH3+6OH﹣.
(4)25℃时,amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),二者发生反应:HCl+NH3•H2O═NH4Cl+H2O,反应后溶液恰好显中性,则溶液中存在c(H+)=c(OH﹣)=10﹣7mol/L,生成的NH4Cl水解会使溶液呈酸性,这里溶液显中性,因此可以判断是稍过量,平衡时,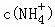 =
=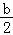 mol/L,c(NH3•H2O)=
mol/L,c(NH3•H2O)=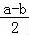 mol/L,NH3•H2O的电离平衡常数表达式为:
mol/L,NH3•H2O的电离平衡常数表达式为: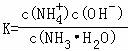 =
=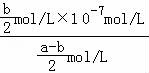 =
=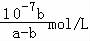 .故答案为:
.故答案为: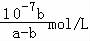 .
.
【点评】本题考查盖斯定律的应用,平衡常数的表达式及其计算,化学平衡的移动,电解原理,属化学原理知识,需注意实验平衡常数的单位.值得一提的是,最后一问求解的平衡常数,学过大学无机化学的就会知道,这是一个缓冲溶液,可以直接使用公式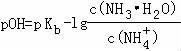 计算.题目考查较为综合,难度不大,是基础题.
计算.题目考查较为综合,难度不大,是基础题.
(10分)一水硫酸四氨合铜(II)的化学式为SO4•H2O合成路线如图1:

图1

图2 图3
己知:2+(aq)⇌Cu2+(aq)+4NH3(aq);(NH4)2SO4在水中可溶,在乙醇中难溶;SO4•H2O在乙醇水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图2:
(1)流程图中气体X的主要成分 (填化学式),步骤1需要加什么酸 (填名称).
(2)有同学提出:从溶液D到产品的步骤2,可以采用的操作方法依次是:加热蒸发、冷却结晶、抽滤、洗涤、干燥.请评价其合理性,并说明理由 ;请另外再提出一种合理的实验方案 (不要求具体的实验步骤).
(3)抽滤装置如图3所示,该装置中的错误之处是 ;抽滤完毕或中途需停止抽滤时,应先 ,然后 .
知识点:化学
(1)SO2(O2);硫酸;
(2)不合理,加热蒸发,温度升高,NH3放出,会促进[Cu(NH3)4]2+(aq)⇌Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,使得到的产物晶体会含有杂质[Cu(OH)2或Cu2(OH)2 SO4等;向溶液D中加入适量乙醇,再过滤、洗涤、干燥;
(3)布氏漏斗的瓶口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管,关闭抽气装置中的水龙头.
【考点】制备实验方案的设计.
【分析】辉铜矿Cu2S(主要杂质Fe3O4)通入氧气充分煅烧,发生反应:Cu2S+2O2 2CuO+SO2,则气体X为二氧化硫与过量的氧气,固体B为CuO、Fe3O4,加入硫酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,过滤,向含有[Cu(NH3)4]2+的滤液中加入适量乙醇,再过滤、洗涤、干燥,得产品一水硫酸四氨合铜,据此分析作答.
2CuO+SO2,则气体X为二氧化硫与过量的氧气,固体B为CuO、Fe3O4,加入硫酸得到含有Cu2+、Fe3+的溶液,加入过量氨水,可得到[Cu(NH3)4]2+和Fe(HO)3,过滤,向含有[Cu(NH3)4]2+的滤液中加入适量乙醇,再过滤、洗涤、干燥,得产品一水硫酸四氨合铜,据此分析作答.
【解答】解:(1)辉铜矿通入氧气充分煅烧,发生反应:Cu2S+2O2 2CuO+SO2,则气体X为二氧化硫与过量的氧气,固体B为CuO、Fe3O4,经过步骤1得到含有Cu2+、Fe3+的溶液,为不引入杂质,故应加硫酸;
2CuO+SO2,则气体X为二氧化硫与过量的氧气,固体B为CuO、Fe3O4,经过步骤1得到含有Cu2+、Fe3+的溶液,为不引入杂质,故应加硫酸;
故答案为:SO2(O2);硫酸;
(2)溶液D为含有[Cu(NH3)4]2+的溶液,加热蒸发,温度升高,NH3放出,会促进2+(aq)⇌Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,使得到的产物晶体会含有杂质Cu(OH)2或Cu2(OH)2 SO4等;由题);Cu(NH3)2SO4在水中可溶,在乙醇中难溶,向溶液D中加入适量乙醇,再过滤、洗涤、干燥;
故答案为:不合理,加热蒸发,温度升高,NH3放出,会促进[Cu(NH3)4]2+(aq)⇌Cu2+(aq)+4NH3(aq)平衡正移,Cu2+水解,使得到的产物晶体会含有杂质[Cu(OH)2或Cu2(OH)2 SO4等;向溶液D中加入适量乙醇,再过滤、洗涤、干燥;
(3)题目图3所示装置为抽滤装置,装置中存在的错误是:布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,这样不利于吸滤.抽滤完毕或中途停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头;
故答案为:布氏漏斗的瓶口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管,关闭抽气装置中的水龙头.
【点评】本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力的考查,题目涉及化学平衡移动、结晶方式的分析等,弄清实验原理、目的、要求、步骤和注意事项是解题的关键,中等难度.
(10分)化合物G( )有广泛应用.合成G的一种路径如图.1H﹣NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.
)有广泛应用.合成G的一种路径如图.1H﹣NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应,D的组成为C8H10.

已知①
 R1CHO+
R1CHO+
②RNH2+

 +H2O
+H2O
(1)由A生成B的化学方程式为 .
(2)C的结构简式为 .
(3)由D生成E的化学方程式为 .
(4)写出同时符合下列条件的F的所有同分异构体的结构简式 .
①1H﹣NMR谱显示分子中含有苯环;
②核磁共振氢谱为4组峰,且面积比为6:2:2:1
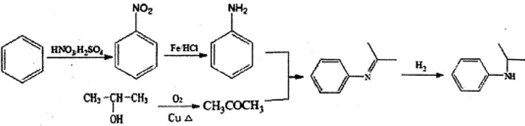
(5)设计由苯及2﹣丙醇合成N﹣异丙基苯胺( )的合成路线(流程图表示,无机试剂任选)
)的合成路线(流程图表示,无机试剂任选)
.
知识点:化学
(1)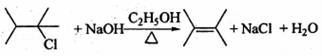 ;
;
(2) ;
;
(3)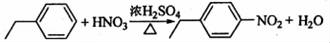 ;
;
(4)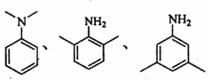 ;
;
(5)
【考点】有机物的合成.
【分析】根据A的分子式知,A属于饱和氯代烃,A发生消去反应生成B,B发生信息①的反应生成C,C和F发生信息②的反应生成G,根据G结构简式知,C中含有3个C原子且1H﹣NMR谱显示C结构中只有一种环境的氢且不能发生银镜反应,所以C的结构简式为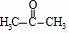 ,信息①的反应只有一种产物,则B结构简式为CH3CH2CH=CHCH2CH3,A结构简式为CH3CH2CH2CHClCH2CH3;
,信息①的反应只有一种产物,则B结构简式为CH3CH2CH=CHCH2CH3,A结构简式为CH3CH2CH2CHClCH2CH3;
根据信息②、F分子式及G结构简式知,F结构简式为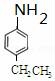 ,D的组成为C8H10,结合F结构简式知,D为
,D的组成为C8H10,结合F结构简式知,D为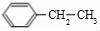 ,D发生取代反应生成E,且发生对位取代反应,则E结构简式为
,D发生取代反应生成E,且发生对位取代反应,则E结构简式为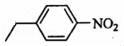 ;
;
(5)苯和浓硝酸发生取代反应生成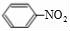 ,
,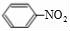 发生还原反应生成
发生还原反应生成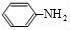 ;2﹣丙醇发生催化氧化反应生成
;2﹣丙醇发生催化氧化反应生成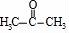 ,
,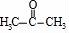 和
和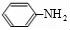 发生取代反应然后发生加成反应生成
发生取代反应然后发生加成反应生成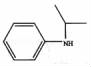 .
.
【解答】解:根据A的分子式知,A属于饱和氯代烃,A发生消去反应生成B,B发生信息①的反应生成C,C和F发生信息②的反应生成G,根据G结构简式知,C中含有3个C原子且1H﹣NMR谱显示C结构中只有一种环境的氢且不能发生银镜反应,所以C的结构简式为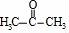 ,信息①的反应只有一种产物,则B结构简式为CH3CH2CH=CHCH2CH3,A结构简式为CH3CH2CH2CHClCH2CH3;
,信息①的反应只有一种产物,则B结构简式为CH3CH2CH=CHCH2CH3,A结构简式为CH3CH2CH2CHClCH2CH3;
根据信息②、F分子式及G结构简式知,F结构简式为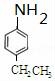 ,D的组成为C8H10,结合F结构简式知,D为
,D的组成为C8H10,结合F结构简式知,D为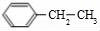 ,D发生取代反应生成E,且发生对位取代反应,则E结构简式为
,D发生取代反应生成E,且发生对位取代反应,则E结构简式为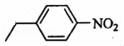 ;
;
(1)A发生消去反应生成B,则由A生成B的化学方程式为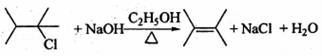 ,
,
故答案为: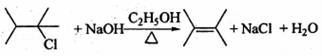 ;
;
(2)通过以上分析知,C的结构简式为 ,故答案为:
,故答案为: ;
;
(3)D发生取代反应生成E,由D生成E的化学方程式为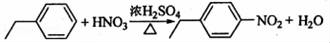 ,
,
故答案为: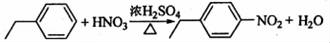 ;
;
(4)F结构简式为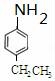 ,F同分异构体符合下列条件:
,F同分异构体符合下列条件:
①1H﹣NMR谱显示分子中含有苯环;
②核磁共振氢谱为4组峰,且面积比为6:2:2:1,说明含有四种氢原子且四种氢原子个数之比为6:2:2:1,
则符合条件的同分异构体结构简式为 ,
,
故答案为: ;
;
(5)苯和浓硝酸发生取代反应生成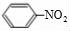 ,
,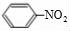 发生还原反应生成
发生还原反应生成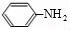 ;2﹣丙醇发生催化氧化反应生成
;2﹣丙醇发生催化氧化反应生成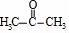 ,
,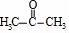 和
和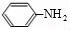 发生取代反应然后发生加成反应生成
发生取代反应然后发生加成反应生成 ,所以其合成路线为,
,所以其合成路线为,

故答案为:
 .
.
【点评】本题考查有机物推断及有机合成,为高频考点,根据分子式、反应条件、题给信息采用正逆结合的方法进行推断,侧重考查学生分析判断、综合分析及运用、知识迁移能力,难点是合成路线设计,题目难度中等.