下列叙述正确的是( )
A.原电池将电能转化为化学能 B.电解池将化学能转化为电能
C.原电池的负极失电子 D.电解池的阳极发生还原反应
知识点:化学
C
【考点】原电池和电解池的工作原理.
【分析】A、原电池是将化学能转化为电能的装置;
B、电解池是将电能转化为化学能的装置;
C、原电池负极发生氧化反应;
D、电解池阳极发生氧化反应.
【解答】解:A、原电池是将化学能转化为电能的装置,而不是电能转化为化学能,故A错误;
B、电解池是将电能转化为化学能的装置,而不是将化学能转化为电能,故B错误;
C、原电池负极发生氧化反应,失电子,故C正确;
D、电解池阳极发生氧化反应,而不是还原反应,故D错误;
故选C.
纯水不导电,它属于( )
A.强电解质 B.弱电解质 C.非电解质 D.离子化合物
知识点:化学
B
【考点】电解质溶液的导电性.
【分析】水为共价化合物,可发生电离,以此解答该题.
【解答】解:水为共价化合物,可发生电离,为弱电解质,故选B.
下列叙述不正确的是( )
A.升温水的离子积增大
B.pH=7的溶液一定显中性
C.NaHSO4 溶液一定显酸性
D.用氢氧化钠溶液滴定硫酸溶液到滴定终点时,混合溶液不一定显中性
知识点:化学
B
【考点】水的电离.
【分析】A.水的电离是吸热过程,升温促进电离平衡正向进行;
B.水的电离为吸热反应,温度影响水的离子积,温度升高,水电离出氢离子浓度增大;
C.NaHSO4是强酸酸式盐,为强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42﹣,导致溶液中c(H+)>c(OH﹣);
D.滴定终点的指示剂变色范围分析;
【解答】解;A.水的电离是吸热过程,升温促进电离平衡正向进行,离子积常数增大,故A正确;
B.溶液的酸碱性是根据溶液中H+浓度与OH﹣浓度的相对大小,当c(H+)=c(OH﹣),溶液呈中性.常温下,水的离子积Kw=1×10﹣14,所以pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热的,温度越高Kw越大,如100℃时,水的离子积常数是10﹣12,当pH=6时溶液呈中性,此时pH=7时溶液呈碱性,该选项中pH=7的溶液,不一定是在常温下,溶液中c(H+)、c(OH﹣)不一定相等,故B错误;
C.NaHSO4是强酸酸式盐,为强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42﹣,导致溶液中c(H+)>c(OH﹣),则该溶液呈酸性,故C正确;
D.用氢氧化钠溶液滴定硫酸溶液到滴定终点时,指示剂指示反应终点的变色不一定正好在PH=7,所以混合溶液不一定显中性,故D正确;
故选B.
酸式滴定管不能装的溶液是( )
A.稀硫酸 B.氯化钠溶液 C.高锰酸钾溶液 D.碳酸钠溶液
知识点:化学
D
【考点】计量仪器及使用方法.
【分析】玻璃中含有二氧化硅,二氧化硅与碱性溶液反应,酸性溶液或强氧化性溶液可氧化腐蚀橡胶,则酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液.
【解答】解:A.稀硫酸为酸性溶液,可以用酸式滴定管装液,故A不选;
B.氯化钠为强酸强碱盐,溶液呈中性,可以用酸式滴定管装液,故B不选;
C.高锰酸钾溶液具有强氧化性,不能用碱式滴定管,可用酸式滴定管装液,故C不选;
D.碳酸钠为强碱弱酸盐,碳酸根离子水解CO32﹣+H2O⇌HCO3﹣+OH﹣,HCO3﹣+H2O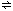 H2CO3+OH﹣,溶液呈碱性,酸式滴定管不能装该液体,故D选;
H2CO3+OH﹣,溶液呈碱性,酸式滴定管不能装该液体,故D选;
故选D.
弱酸弱碱盐溶液显( )性.
A.一定显酸性 B.一定显碱性
C.一定显中性 D.可能显酸性、碱性或中性
知识点:化学
D
【考点】盐类水解的应用.
【分析】弱酸弱碱盐溶液中弱碱阳离子水解显酸性,弱酸阴离子水解显碱性,二者水解程度大小不同,溶液酸碱性不同.
【解答】解:弱酸弱碱盐溶液中弱碱阳离子水解显酸性,弱酸阴离子水解显碱性,二者水解程度大小不同,溶液酸碱性不同,若弱碱阳离子水解程度大,溶液显酸性,弱弱酸阴离子水解程度大溶液显碱性,弱二者水解程度相近,溶液显中性,故选D.
下列说法正确的是( )
A.难溶物在水中的溶解度为0
B.绝对不溶解的物质是不存在的
C.难溶物是指物质不溶于水
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
知识点:化学
B
【考点】难溶电解质的溶解平衡及沉淀转化的本质.
【分析】一般来说,物质的溶度积越小,则溶解度越小,当浓度小于10﹣5mol/L时可认为完全溶解,可利用沉淀的转化除杂,以此解答该题.
【解答】解:某物质的溶解性为难溶,则该物质的溶解度小于0.1g,难溶是相对的,不溶的物质不存在,当浓度≤1×10﹣5mol/L时,可认为完全沉淀,只有B正确.
故选B.
对碱性锌锰电池的判断正确的是( )
A.锌为负极,二氧化锰为正极
B.锌为正极,二氧化锰为负极
C.工作时电子由二氧化锰经外电路流向锌极
D.锌电极发生还原反应,二氧化锰发生氧化反应
知识点:化学
A
【考点】原电池和电解池的工作原理.
【分析】碱性锌锰电池中失电子的一极为负极,负极发生氧化反应,得电子的一极为正极,正极发生还原反应,电子从负极经过外电路流向正极,据此分析.
【解答】解:A、碱性锌锰电池中,锌失电子作负极,MnO2得电子作正极,故A正确;
B、碱性锌锰电池中,锌失电子作负极,MnO2得电子作正极,故B错误;
C、工作时电子从负极经过外电路流向正极,即电子由Zn经外电路流向MnO2,故C错误;
D、锌失电子发生氧化反应,MnO2电极得电子发生还原反应,故D错误;
故选A.
氯碱工业的基本原理就是电解饱和食盐水.下列关于实验室电解饱和食盐水的说法中正确的说法是( )
A.可以选用炭棒作为阴、阳极材料,但阳极材料也可以用铁棒
B.用湿润的淀粉KI试纸靠近阴极区域,试纸变蓝
C.电解过程中,在阴极区域溶液中滴加酚酞,溶液变红色
D.实验结束后将溶液搅拌,然后用pH试纸检验,溶液呈中性
知识点:化学
C
【考点】氯碱工业.
【分析】A.选用炭棒作为阴、阳极材料,电解饱和食盐水阴极上氢离子放电,同时得到氢氧根离子,阳极氯离子失去电子生成氯气;金属作阳极,阳极是活泼金属本身放电;
B.湿润的淀粉KI试纸变蓝,是因碘单质和淀粉作用显示蓝色,阴极无氯气,碘离子和淀粉不显蓝色;
C.用惰性材料作阴极,电解饱和食盐水阴极上氢离子放电,同时得到氢氧根离子,碱能使酚酞变红;
D.电解氯化钠溶液的产物是氢氧化钠和氢气、氯气.
【解答】解:A.金属作阳极,阳极是活泼金属铁本身放电,电极反应方程式为:Fe﹣2e﹣═Fe2+,故A错误;
B.选用炭棒作为阴、阳极材料,电解饱和食盐水时,阴极反应式为:2H2O﹣2e﹣═2OH﹣+H2↑,阳极反应式为:2Cl﹣﹣2e﹣═Cl2↑,阴极产物为NaOH和H2,无Cl2,试纸不会变蓝,故B错误;
C.用惰性材料作阴极,电解饱和食盐水阴极上氢离子放电,同时得到氢氧根离子,在阴极区域溶液中滴加酚酞,溶液变红色,故C正确;
D.电解一段时间后,所得的电解质溶液是氢氧化钠溶液,将电解液全部转移到烧杯中,会显示碱性,故D错误;
故选C.
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时阳极的电极反应式为:2Cl﹣﹣2e﹣═Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e﹣═4OH﹣
C.粗铜精炼时,与电源正极相连的是铜
D.钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣═Fe2+
知识点:化学
A
【考点】原电池和电解池的工作原理.
【分析】A.电解饱和食盐水时,阳极上氯离子失电子生成氯气;
B.氢氧燃料电池中氢气在负极失电子;
C.粗铜精炼时,与电源正极相连的是阳极,所以是粗铜;
D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应.
【解答】解:A.用惰性电极电解饱和食盐水,阳极上氯离子放电,电极反应式为2Cl﹣﹣2e﹣═Cl2↑,故A正确;
B.酸性氢氧燃料电池中,负极上燃料失电子生成氢离子,负极反应式为H2﹣2e﹣=2H+,故B错误;
C.粗铜精炼时,与电源正极相连的是阳极,所以是粗铜,而不是纯铜,故C错误;
D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应,电极反应式为Fe﹣2e﹣═Fe2+,故D错误;
故选A.
为了防止钢铁锈蚀,下列防护方法中正确的是( )
A.在精密机床的铁床上安装铜螺钉
B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里
D.在地下输油的铸铁管上接直流电源的正极
知识点:化学
C
【考点】金属的电化学腐蚀与防护.
【分析】作原电池负极或电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护,要保护金属不被腐蚀,应该使该金属作原电池正极或电解池阴极,据此分析解答.
【解答】解:A.Cu、Fe和电解质溶液构成原电池,Fe易失电子作负极、Cu作正极,所以Fe易被腐蚀,故A不选;
B.Fe、石墨和海水构成原电池,Fe易失电子作负极、C作正极,所以Fe易被腐蚀,故B不选;
C.Zn、Fe和海水构成原电池,Zn易失电子作负极、Fe作正极,所以Fe被保护,故C选;
D.铸铁连接直流电源正极时作电解池阳极,加速被腐蚀,故D不选;
故选C.
下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.氢氧燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
知识点:化学
B
【考点】常见化学电源的种类及其工作原理.
【分析】A.锂离子电池属于二次电池;
B.铜锌原电池放电时,电子从负极沿导线流向正极;
C.氢氧燃料电池属于原电池;
D.锌锰干电池中,锌易失电子而作负极.
【解答】解:A.锂离子电池中能循环使用,属于二次电池,故A正确;
B.铜锌原电池中,锌易失电子而作负极,铜作正极,电子从负极沿导线流向正极,故B错误;
C.燃料电池属于原电池,是将化学能转变为电能的装置,故C正确;
D.锌锰干电池中,锌易失电子发生氧化反应而作负极,故D正确;
故选B.
废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.石墨 B.二氧化锰 C.锌 D.重金属
知识点:化学
D
【考点】"三废"处理与环境保护.
【分析】废旧电池含有石墨、二氧化锰、锌以及金属等,其中重金属对人体有害,以此解答该题.
【解答】解:废电池里含有大量重金属汞、镉、锰、铅等,废旧电池对土壤、水等环境造成污染,控制废电池危害的根本措施是禁止生产和销售危害性大的电池,特别是含汞或镉的电池,大力开展无公害的环保型电池电池,对于废旧电池,则应当及时回收,集中进行安全处理,
故选D.
我国某大城市今年夏季多次降下酸雨.据环保部门测定,该城市整个夏季酸雨的pH平均为3.2.在这种环境中的铁制品极易被腐蚀.对此条件下铁的腐蚀的叙述不正确的是( )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为 2H2O+O2+4e﹣═4OH﹣
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe﹣2e﹣═Fe2+
知识点:化学
B
【考点】金属的电化学腐蚀与防护.
【分析】酸雨pH=3.5,所以酸雨中含有大量氢离子;铁制品中含有铁和碳,具备了原电池的构成条件,所以构成了原电池;铁作负极,铁失去电子生成二价铁离子,碳作正极,溶液中的氢离子得电子生成氢气.
【解答】解:A、金属铁的腐蚀中,金属铁可以和酸中的氢离子直接发生化学腐蚀,铁制品中含有铁和碳,再加之电解质环境,具备了原电池的构成条件,所以构成了原电池,会发生电化学腐蚀,故A正确;
B、发生电化学腐蚀时,碳作正极,溶液中的氢离子得电子生成氢气,2H++2e﹣=H2↑,故B错误;
C、发生电化学腐蚀时,碳作正极,发生反应:2H++2e﹣=H2↑,有氢气产生,故C正确;
D、发生电化学腐蚀时的负极是金属铁,电极反应式为:Fe﹣2e﹣═Fe2+,故D正确.
故选B.
已知:2Zn(s)+O2(g)=2ZnO(s)△H=﹣701.0kJ•mol﹣1 2Hg(l)+O2(g)=2HgO(s)△H=﹣181.6kJ•mol﹣1则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A.+519.4kJ•mol﹣1 B.﹣519.4kJ•mol﹣1
C.+259.7kJ•mol﹣1 D.﹣259.7kJ•mol﹣1
知识点:化学
D
【考点】用盖斯定律进行有关反应热的计算.
【分析】根据盖斯定律,利用已知方程式进行叠加,构造出目标反应式,关键在于设计反应过程,注意:(1)当反应式乘以或除以某数时,△H也应乘以或除以某数. (2)反应式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“﹣”符号,即把△H看作一个整体进行运算.
【解答】解:已知:①2Zn(s)+O2(g)=2ZnO(s)△H=﹣701.0kJ•mol﹣1
②2Hg(l)+O2(g)=2HgO(s)△H=﹣181.6kJ•mol﹣1
根据盖斯定律,①﹣②得2Zn(s)+2HgO(s)=2ZnO(s)+2Hg(l),△H=﹣519.4kJ•mol﹣1.
即Zn(s)+HgO(s)=ZnO(s)+Hg(l),△H=﹣259.7kJ•mol﹣1.
故选:D
关于如图所示装置的叙述,正确的是( )

A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流方向从锌片经导线流向铜片
D.铜离子在铜片表面被还原
知识点:化学
D
【考点】原电池和电解池的工作原理.
【分析】该反应能自发进行,所以该装置是原电池,根据电子流向知,锌作负极,铜作,负极上锌失电子发生氧化反应,正极上铜离子得电子发生还原反应,由此分析解答.
【解答】解:A.该反应能自发进行,所以该装置是原电池,根据电子流向知,锌作负极,铜作正极,铜电极上铜离子得电子生成铜,故A错误;
B.该原电池中,铜电极上铜离子得电子生成铜,所以铜电极质量逐渐增加,故B错误;
C.该原电池中,锌作负极,铜作正极,所以电流从铜片沿导线流向锌片,故C错误;
D.该原电池中,铜电极上铜离子得电子发生还原反应而生成铜,被还原,故D正确;
故选D.
某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2,下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2,下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;④蓄电池的电极必须浸在某碱性溶液中.
A.①②③ B.①②④ C.①③④ D.②③④
知识点:化学
D
【考点】原电池和电解池的工作原理.
【分析】根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O.
【解答】解:①由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故①错误;
②充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e﹣=Fe+2OH﹣,故②正确;
③充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O,Ni(OH)2做阳极,故③正确.
④根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,所以电解质溶液是碱,故④正确;
故选D.
通常人们把拆开1mol某化学键所吸收的能量或形成lmol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(△H)已知
化学键
H﹣H
Cl﹣Cl
H﹣Cl
键能
436kJ/mol
243kJ/mol
431kJ/mol
则下列热化学方程式不正确的是( )
A. H2(g)+
H2(g)+ Cl2(g)═HCl(g)△H=﹣91.5kJ/mol
Cl2(g)═HCl(g)△H=﹣91.5kJ/mol
B.H2(g)+Cl2(g)═2HCl(g)△H=﹣183kJ/mol
C. H2(g)+
H2(g)+ Cl2(g)═HCl(g)△H=+91.5kJ/mol
Cl2(g)═HCl(g)△H=+91.5kJ/mol
D.2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ/mol
知识点:化学
C
【考点】热化学方程式.
【分析】焓变等于断键吸收的能量减去成键释放的能量,且物质的量与热量成正比,互为逆反应时的焓变数值相同、符号相反,以此来解答.
【解答】解:由表格中的数据可知,H2(g)+Cl2(g)═2HCl(g)△H=﹣183kJ/mol,
由物质的量与热量成正比可知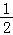 H2(g)+
H2(g)+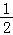 Cl2(g)═HCl(g)△H=﹣91.5kJ/mol,
Cl2(g)═HCl(g)△H=﹣91.5kJ/mol,
由互为逆反应时的焓变数值相同、符号相反可知2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ/mol,
故选C.
下列关于化学平衡常数的说法正确的是( )
A.化学平衡发生移动,平衡常数必发生变化
B.平衡常数发生变化,化学平衡必发生移动
C.改变浓度,平衡常数一定改变
D.催化剂改变达到平衡的时间,必引起平衡常数的改变
知识点:化学
B
【考点】化学平衡常数的含义.
【分析】平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关,与浓度、压强、催化剂无关,平衡常数越大,说明可逆反应进行的程度越大.
【解答】解:A、同一反应,平化学衡常数只受温度影响,非温度改变的平衡移动,平衡常数不变,故A错误;
B、根据平衡常数的定义可知,平衡常数发生变化,化学平衡必发生移动,故B正确;
C、同一反应,平化学衡常数只受温度影响,改变浓度平衡常数不变,故C错误;
D、同一反应,平化学衡常数只受温度影响,所以催化剂不会引起平衡常数的改变,故D错误;
故选B.
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4υ正(O2)=5υ逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
知识点:化学
A
【考点】化学平衡建立的过程.
【分析】A、当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学化学计量数之比(不同物质),各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;
B、都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡;
C、增大体积压强减小,正逆速率都减小,平衡向体积增大的方向移动;
D、各物质表示的化学反应速率之比等于各物质前面的系数之比.
【解答】解:A、4v正(O2)=5v逆(NO),不同物质表示正逆反应速率之比等于化学计量数之比,表示反应达到平衡状态,故A正确;
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡,故B错误;
C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小,平衡向正反应移动,故C错误;
D、化学反应速率关系是:3υ正(NH3)=2υ正(H2O),故D错误.
故选A.
下列关于离子共存的说法正确的是( )
A.某无色溶液中可能大量存在H+、Cl﹣、MnO4﹣
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32﹣
C.含AlO2﹣的溶液中:Na+、K+、NO3﹣、Al3+
D.含大量Fe3+的溶液中:K+、Na+、NO3﹣、H+
知识点:化学
D
【考点】离子共存问题.
【分析】A.MnO4﹣为紫色,且离子之间发生氧化还原反应;
B.pH=2的溶液,显酸性;
C.离子之间相互促进水解;
D.该组离子之间不反应.
【解答】解:A.MnO4﹣为紫色,与无色不符,且H+、Cl﹣、MnO4﹣发生氧化还原反应,不能大量共存,故A错误;
B.pH=2的溶液,显酸性,不能大量存在SiO32﹣,故B错误;
C.AlO2﹣、Al3+相互促进水解,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)(正反应为放热反应),下列说法中正确的是( )
A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,N2的浓度比原平衡的小
B.达到平衡后,升高温度,既加快了正、逆反应速率,又提高NH3的产率
C.达到平衡后,缩小容器体积,既有利于加快正、逆反应速率,又有利用提高氢气的转化率
D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应速率减小了
知识点:化学
C
【考点】化学平衡的影响因素.
【分析】A、平衡移动的结果是减弱,而不是抵消;
B、正反应是放热反应;
C、缩小容器体积,相当于增大压强,既有利于加快正、逆反应速率,平衡正向移动;
D、加入催化剂同等程度加快正逆反应的速率.
【解答】解:A、平衡移动的结果是减弱,而不是抵消,所以达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,N2的浓度比原平衡的大,故A错误;
B、正反应是放热反应,所以升高温度,既加快了正、逆反应速率,平衡逆向移动,所以降低NH3的产率,故B错误;
C、缩小容器体积,相当于增大压强,既有利于加快正、逆反应速率,平衡正向移动,所以有利用提高氢气的转化率,故C正确;
D、加入催化剂可以缩短达到平衡的时间,是因为正、逆反应速率都加快,故D错误;
故选C.
100℃时,水的离子积为1×10﹣12,若该温度下某溶液中的H+浓度为1×10﹣7mol/L则该溶液是( )
A.酸性 B.碱性 C.中性 D.无法判断
知识点:化学
B
【考点】离子积常数.
【分析】100℃时,纯水中pH=﹣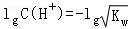 =6,当溶液的pH=6时,为中性,当pH>6时呈碱性,当pH<6时呈酸性,据此分析解答.
=6,当溶液的pH=6时,为中性,当pH>6时呈碱性,当pH<6时呈酸性,据此分析解答.
【解答】解:100℃时,纯水中pH=﹣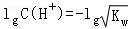 =6,若该温度下某溶液中的H+浓度为1×10﹣7mol/L,
=6,若该温度下某溶液中的H+浓度为1×10﹣7mol/L,
则该溶液的pH=﹣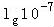 =7>6,所以该溶液呈碱性,故选B.
=7>6,所以该溶液呈碱性,故选B.
常温下,将0.1mol•L﹣1氢氧化钠溶液与0.06mol•L﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
知识点:化学
B
【考点】pH的简单计算.
【分析】根据酸碱溶液混合时,先判断过量,然后计算过量的酸或碱的物质的量浓度,最后计算溶液的pH来解答即可.
【解答】解:设溶液的体积都是1L,则氢氧化钠的物质的量为1L×0.1mol•L﹣1=0.1mol,
硫酸的物质的量为1L×0.06mol•L﹣1=0.06mol,H+的物质的量为0.06mol×2=0.12mol,
则当酸碱发生中和时H+和OH﹣的物质的量分别为0.12mol和0.1mol,
则硫酸过量,过量的H+的物质的量为0.12mol﹣0.1mol=0.02mol,
则反应后溶液中H+的物质的量浓度为c(H+)= =0.01 mol•L﹣1,
=0.01 mol•L﹣1,
pH=﹣lg10﹣2=2.0,故选:B.
有体积相同、相等pH的烧碱溶液和氨水,下列叙述中正确的是( )
A.两溶液物质的量浓度相同
B.用同浓度的盐酸中和时,消耗盐酸的体积相同
C.两溶液中OH﹣离子浓度相同
D.加入等体积的水稀释后,pH仍相等
知识点:化学
C
【考点】弱电解质在水溶液中的电离平衡.
【分析】一水合氨是弱电解质,所以在氨水中存在电离平衡,氢氧化钠是强电解质,等pH的氨水和氢氧化钠,氢氧化钠的浓度小于氨水,等体积等PH的两种溶液,氨水的物质的量大于氢氧化钠.
【解答】解:A.一水合氨是弱电解质,在氨水中存在电离平衡,氢氧化钠是强电解质,在水溶液里完全电离,所以等pH的氨水和氢氧化钠溶液,氨水的浓度大于氢氧化钠溶液,故A错误;
B.等pH的氨水和氢氧化钠,氨水的浓度大于氢氧化钠溶液,则等pH等体积的两种溶液中,氨水的物质的量大于氢氧化钠,则用同浓度的盐酸中和时,氨水消耗盐酸的体积多,故B错误;
C.pH相等的两种溶液中氢氧根离子浓度相等,故C正确;
D.加水稀释氨水促进一水合氨电离,所以稀释等体积后,氨水中氢氧根离子浓度大,则氨水的pH大于氢氧化钠,故D错误;
故选C.
在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.[Na+]=[CH3COO﹣]+[CH3COOH] B.[H+]=[CH3COO﹣]+[OH﹣]
C.[Na+]>[CH3COO﹣]>[OH﹣]>[H+] D.[CH3COO﹣]>[Na+]>[H+]>[OH﹣]
知识点:化学
D
【考点】离子浓度大小的比较.
【分析】CH3COOH为弱酸,在25℃时将pH=11的NaOH溶液与pH=3的CH3COOH溶掖等体积混合时,由于醋酸为弱酸,醋酸过量,溶液呈酸性,则:[CH3COO﹣]>[Na+]>[H+]>[OH﹣]、[Na+]<[CH3COO﹣]+[CH3COOH],根据电荷守恒可得:[Na+]+[H+]=[CH3COO﹣]+[OH﹣],据此进行解答.
【解答】解:A、设溶液的体积都为1L,CH3COOH为弱酸,在25℃时将pH=11的NaOH溶液与pH=3的CH3COOH溶掖等体积混合时,醋酸过量,反应后的溶液中有n(Na+)=0.001mol,n(CH3COO﹣)+n(CH3COOH)>0.001mol,则:[Na+]<[CH3COO﹣]+[CH3COOH],故A错误;
B、根据溶液呈电中性,溶液中存在:[Na+]+[H+]=[CH3COO﹣]+[OH﹣],则[H+]<[CH3COO﹣]+[OH﹣],故B错误;
C、在25℃时将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合时,醋酸过量,则:[CH3COO﹣]>[Na+],故C错误;
D、在25℃时将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合时,醋酸过量,溶液呈酸性,则有:[CH3COO﹣]>[Na+]、[H+]>[OH﹣],由于H+离子与OH﹣离子反应,则溶液中[Na+]>[H+],所以有:[CH3COO﹣]>[Na+]>[H+]>[OH﹣],故D正确;
故选D.