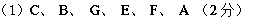下列叙述正确的是
A.SO2能使品红溶液褪色是因为SO2具有氧化性,所以它也能使酸碱指示剂褪色
B.硫化氢中硫显最低价态-2价,因此只具有还原性
C.浓硫酸使木棒或棉花变黑,体现了浓硫酸的吸水性
D.BaSO4可作“钡餐”进行X射线检查
知识点:氧族元素
D
下列说法正确的是
A. 12C、13C、14C、金刚石、石墨都是碳元素的同位素
B.同种元素的原子,质量数一定相同
C.互为同位素的原子,质子数一定相同
D.由一种元素组成的物质,一定是纯净物
知识点:物质的结构与性质
C
下列叙述正确的是
A.由NH3制碳铵和硫铵是“固氮”过程
B.浓硝酸虽然是氧化性酸,但是不能氧化单质银
C.SO2氧化为SO3时,使用催化剂可以提高硫酸的产率
D.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以使SO3吸收完全
知识点:氮族元素
D
下列事实与浓硫酸具有强氧化性有关的是
①常温时用铁制容器运输浓硫酸 ②硫酸工业生产中,用浓硫酸吸收SO3 ③浓硫酸使蔗糖炭化变黑并有大量气体产生 ④浓硫酸用于生产磷肥 ⑤浓硫酸不能用来干燥HBr
A.①③④ B.①②③
C.①③⑤ D.②③④⑤
知识点:氧族元素
C
下列各组离子能大量共存的是
A.Na+、Ba2+、S2-、SO32- B.H+、K+、HSO3-、S2-
C.Fe2+、H+、Cl-、NO32- D.K+、NH4+、SO42-、NO3-
知识点:离子方程式
D
下列离子方程式中正确的是
A.氨水与亚硫酸溶液混合:NH3·H2O+H+===NH+H2O
B.SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O===CaSO3↓+2HClO
C.铜与浓硫酸共热:Cu+4H++SOCu2++SO2↑+2H2O
D.把H2S通入CuSO4溶液中:H2S+Cu2+===CuS↓+2H+
知识点:离子方程式
D
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的

A.氢氧化钠溶液、二氧化碳
B.盐酸、氨气
C.氢氧化钠溶液、一氧化碳
D.石灰水、二氧化硫
知识点:元素及其化合物的综合运用
C
下列所述变化规律正确的是
A. Na、Mg、Al还原性依次增强 B. HCl、PH3、H2S稳定性依次减弱
C. NaOH、KOH、CsOH碱性依次增强 D. S2-、Cl-、K+、Ca2+离子半径依次增大
知识点:元素周期律与元素周期表
C
欲检验某无色溶液中是否含有SO42-,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是
A.先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀
B.先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀
C.直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀
D.直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀
知识点:物质的检验和鉴别
A
现有等体积混合而成的四组气体:①NO2+NO;②NO2+O2;③HCl+N2;④NO+N2,将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H1,H2,H3,H4,其中高度关系是
A.H2>H3>H1>H4 B.H3>H2>H1>H4
C.H1=H2=H3=H4 D.H1>H2>H3>H4
知识点:氮族元素
A
某无色的混合气体可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL该气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则此气体的组成为

A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
知识点:物质的分离、除杂和提纯
B
从某些性质看,NH3与H2O相当,NH与H3O+相当,NH和OH-相当。下列有关化学方程式不正确的是
A.氯化铵与KNH2反应:NH4Cl+KNH2KCl+2NH3↑
B.二价活泼金属M(下同)与液氨反应:M+2NH3===M(NH2)2+H2
C.盐酸与MNH反应:2HCl+MNH===MCl2+NH3↑
D.氯化铵与MO反应:2NH4Cl+MO===M(NH2)2+2HCl+H2O
知识点:氮族元素
D
在100 mL等物质的量的HBr和H2SO3的混合液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075 mol·L-1 B.0.008 mol·L-1
C.0.075 mol·L-1 D.0.08 mol·L-1
知识点:溶液浓度的计算
D
已知NH3和HCl都能用来作喷泉实验。若在同温同压下用等体积烧瓶,一个收集满NH3,另一个收集满HCl气体,做喷泉实验,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑溶质的扩散及静止时液面高度的影响)

A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
知识点:气体体积的计算
A
已知1—18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是
A.四种元素位于同一周期 B.氢化物的稳定性H2Y>HZ
C.离子的氧化性aW3+> bX+ D.a+3<c-2
知识点:元素周期律与元素周期表
C
将一定量的锌与100mL18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成16.8L气体 (标准状况),将反应后的溶液稀释到1L,测得溶液的c(H+)=1mol/L,则下列叙述中错误的是
A.气体A为二氧化硫和氢气的混合物 B.气体A中二氧化硫和氢气的体积比为4:1
C.反应中共消耗锌95.5g D.反应中共转移电子1.5mol
知识点:化学计算的综合运用
C
俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为115288X。下列有关叙述正确的是
A.115号元素衰变成113号元素是化学变化
B.核素115288X的质量数与中子数之差为173
C.113号元素属于非金属元素
D.115号元素的最高正化合价是 +5
知识点:元素周期律与元素周期表
D
下列叙述正确的是
A.同周期元素的原子半径以VIIA族的为最大
B.同主族元素两种元素原子的核外电子数的差值可能为26
C.短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D.科学家在周期表中金属与非金属的分界线处找到了优良的催化剂
知识点:元素周期律与元素周期表
B
下图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。下列叙述不正确的是

A.三种元素原子半径的大小顺序是:B<A<C
B.元素A最高价氧化物对应的水化物具有强酸性和强氧化性
C.B元素的氧化物、氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能跟水剧烈反应的单质
知识点:元素周期律与元素周期表
A
足量铜与一定量浓硝酸反应得到Cu(NO3)2溶液和NO2、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得Cu(NO3)2溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL
C.30 mL D.15 mL
知识点:化学计算的综合运用
A
(10分)如图所示:

图中每一方格表示有关的一种反应物或生成物,生成物A、B、C的物质的量相等,其中A、C为无色气体。请填写下列空白:
(1)物质X是________,C是________,F是________,G是 。
(2)反应①的化学方程式是
_______________________________________________________________________。
(3)反应②的化学方程式是
________________________________________________________________________。
(4)反应③的离子方程式是
________________________________________________________________________。
知识点:无机框图推断
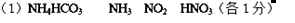
(12分)I.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线。
II.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同周期,也不同族。X原子最外层电子数是核外电子层数的三倍,Y的最高价与最低价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表第 周期,第 族;
N元素位于元素周期表第 周期,第 族。
(2)请写出下列反应的离子方程式:
N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示)
(4)请将X、Z、M、N元素原子半径从大到小排序:
知识点:元素周期律与元素周期表
II(1)X、Y、Z、M、N分别为:氧、氯、硫、氢、硅元素。氧是第2周期,第VIA族;硅是第三周期,第IVA族(每空1分,共4分)
(2)Si+2OH-+H2O=Si O32-+2H2(2分)
(3)氯元素的原子结构示意图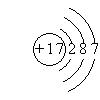 (1分)S2-+Cl2=S+2Cl-(2分)
(1分)S2-+Cl2=S+2Cl-(2分)
(4)N>Z>X>M (硅>硫>氧>氢) (1分)
(7分)
I.下列做法正确的是____________。
A.将浓硝酸保存在棕色玻璃瓶中
B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶
D.氢气还原氧化铜实验先加热再通氢气
E.把烧碱溶液放在带磨口塞的玻璃瓶中
F.把新制氯水放在无色玻璃瓶中
G.用湿润的淀粉碘化钾试纸鉴别NO2和溴蒸气
II.回忆实验室制取氨气的反应原理和实验装置,回答下列问题:
(1)写出加热NH4Cl和Ca(OH)2制取NH3的反应方程式:_______________________________
(2)下列气体能只能用排水法收集的是__________(填选项编号)。
a.NH3 b.NO c.NO2 d. H2 e.CO2
(3)为何不用加热NH4Cl固体的方法制取氨气?_____________________________________
(4)如何检验氨气已收集满试管?_______________________________________________[
知识点:仪器和基本操作

(11分)由下列仪器组成的一套制取SO2并验证它有氧化性、还原性和漂白性。(图中铁架台、铁夹等省略,装置③中E管气体向上流出)②④⑤装置中所用试剂只能从以下物质中选用:氯水、浓H2SO4、溴水、硝酸、品红溶液、烧碱溶液、石灰水。

试回答:
(1)连接仪器时,导气管连接顺序从左到右J接_____、_____接_____、H接D、______接I、______接______。
(2)装置②用以检验SO2的还原性,所盛试剂最好是______,装置④中所盛试剂最好是______,装置⑤中所盛试剂最好是_______,目的是
(3)仪器连接好后,怎样检查装置①的气密性,简述操作要点
(4)书写①装置中反应的化学方程式
书写③装置中反应的化学方程式
知识点:氧族元素