主族元素在周期表的位置,取决于元素原子的( )
A.相对原子质量和核电荷数 B.电子层数和最外层电子数
C.电子层数和质量数 D.金属性和非金属性的强弱
知识点:化学
B
【考点】元素周期表的结构及其应用.
【分析】主族元素在周期表中的位置,与原子结构中的电子层、最外层电子数有关,以此来解答.
【解答】解:原子结构中,电子层数=周期数,最外层电子数=主族序数,
则原子结构中的电子层、最外层电子数决定主族元素在周期表中的位置,
故选B.
乙烯是一种重要的化工原料通常用CH2=CH2来表示,这种表示法是( )
A.电子式 B.结构式 C.结构简式 D.最简式
知识点:化学
C
【考点】结构简式.
【分析】乙烯分子式为C2H4,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构,结合电子式、结构式、结构简式、最简式书写的方法解答.
【解答】解:A.乙烯的电子式为: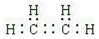 ,故A错误;
,故A错误;
B.乙烯的结构式为 ,故B错误;
,故B错误;
C.乙烯的结构简式为CH2=CH2,故C正确;
D.乙烯的最简式为CH,故D错误;
故选C.
可以用分液漏斗分离的一组液体混合物是( )
A.溴和苯 B.苯和溴苯 C.水和硝基苯 D.苯和汽油
知识点:化学
C
【考点】分液和萃取.
【分析】根据分液漏斗可以将互不相溶的两层液体分开,分析选项中物质的溶解性即可.
【解答】解:A.溴和苯互溶,不能用分液漏斗进行分离,故A错误;
B.苯和溴苯互溶,不能用分液漏斗进行分离,故B错误;
C.水和硝基苯不互溶,能用分液漏斗进行分离,故C正确;
D.苯和汽油互溶,不能用分液漏斗进行分离,故D错误;
故选C.
某Mn+核外有a个电子,该元素的某种原子的质量数为A,则该原子的核内中子数为( )
A.A﹣a+n B.A﹣a﹣n C.A+a﹣n D.A+a+n
知识点:化学
B
【考点】质子数、中子数、核外电子数及其相互联系.
【分析】在阳离子中,质子数=核外电子数+电荷数,中子数=质量数﹣质子数.
【解答】解:Mn+离子有a个电子,电荷数为n,则质子数=核外电子数+电荷数=a+n,故中子数=质量数﹣质子数=A﹣(a+n)=A﹣a﹣n,
故选:B.
下列数值都是烃的相对分子质量,其对应的烃一定为烷烃的是( )
A.54 B.128 C.42 D.58
知识点:化学
D
【考点】烷烃及其命名.
【分析】烷烃是饱和烃,烷烃的通式是:CnH2n+2,将各式量代入CnH2n,余数为2的其对应的烃一定是烷烃.
【解答】解:A.14n=54,解得n=4,少2,分子式为C4H6,其对应的烃为丁炔或二烯烃等,故A错误;
B.相对分子质量为128的烃可以是C9H20或C10H8,不一定是烷烃,故B错误;
C.14n=42,解得n=3,分子式为C3H6,其对应的烃为丙烯或环烷烃,故C错误;
D.14n=58,解得n=4余2,符合烷烃的通式是:CnH2n+2,分子式为C4H10,其对应的烃为丁烷,故D正确.
故选D.
结构相似,在分子组成上相差一个或若干个“CH2”原子团的物质互称为同系物,则下列几组物质中一定为同系物的是( )
A.C3H6和C5H10 B.CH3CH(CH3)CH2CH3和CH3C(CH3)3
C.C2H6和C4H10 D.C2H4和CH2=CH﹣CH=CH2
知识点:化学
C
【考点】芳香烃、烃基和同系物.
【分析】A.分子式符合CnH2n的有机物存在烯烃和环烷烃的同分异构现象;
B.分子式相同,结构不同的化合物,互为同分异构体;
C.碳原子数不同的烷烃互为同系物;
D.同系物要求所含官能团相同且个数相同.
【解答】解:A.同系物必然属于同一类物质,分子式符合CnH2n的有机物存在烯烃和环烷烃的同分异构现象,因此C3H6和C5H10不一定是同系物,故A错误;
B.CH3CH(CH3)CH2CH3和CH3C(CH3)3,分子式相同,结构不同,互为同分异构体,一定不是同系物,故B错误;
C.C2H6和C4H10都属于烷烃,碳原子数不同,一定是同系物,故C正确;
D.C2H4和CH2=CH﹣CH=CH2所含碳碳双键的个数不同,一定不是同系物,故D错误;
故选C.
下列关于碱金属的叙述中,正确的是( )
A.碱金属中密度最小,熔、沸点最高的是铯
B.钠离子核外电子数比钠原子核外电子数少
C.碱金属单质都可保存在煤油中
D.金属钠着火时,可用水或泡沫灭火器灭火
知识点:钠和碱金属
B
【考点】碱金属的性质.
【分析】A.碱金属族元素中,其单质的熔沸点随着原子序数增大而减小,其密度随着原子序数增大而呈增大趋势;
B.钠原子失去一个电子生成钠离子;
C.Li密度小于煤油;
D.钠和水反应生成氢气,钠燃烧生成的过氧化钠和水、二氧化碳反应;
【解答】解:A.碱金属族元素中,其单质的熔沸点随着原子序数增大而减小,其密度随着原子序数增大而呈增大趋势,所以从Li到Cs中,Cs密度最大、熔沸点最低,故A错误;
B.钠原子失去一个电子生成钠离子,所以钠离子核外电子数比钠原子核外电子数少1个,故B正确;
C.Li密度小于煤油,所以Li不能保存在煤油中,故C错误;
D.钠和水反应生成氢气,钠燃烧生成的过氧化钠和水、二氧化碳反应生成氧气,从而促进钠的燃烧,所以金属钠着火时,不可用水或泡沫灭火器灭火,应该用沙土覆盖,故D错误;
故选:B.
下列粒子中,电子数大于质子数且质子数大于中子数的是( )
A.D2O B.Li+ C.OD﹣ D.OH﹣
知识点:原子结构与性质
D
【考点】质量数与质子数、中子数之间的相互关系.
【分析】由于要求电子数大于质子数,据此分析粒子的种类;然后根据质子数大于中子数来分析.
【解答】解:A、由于电子数大于质子数,故离子须为阴离子,故A不选;
B、由于电子数大于质子数,故离子须为阴离子,故B不选;
C、OD﹣是阴离子,故电子数大于质子数;OD﹣中质子数为9,中子数也为9,故C不选;
D、OH﹣是阴离子,故电子数大于质子数;OH﹣中质子数为9,中子数为8,故质子数大于中子数,故D选;
故选D.
有机物种类繁多的原因之一是存在同分异构现象,下列分子式表示的物质不存在同分异构体的是( )
A.C6H6 B.C3H7Br C.C5H10 D.C2HCl5
知识点:有机化合物的分类、命名与结构特点
D
【考点】有机化合物的异构现象.
【分析】A.C6H6可以是链状结构,也可以是环状结构;
B.丙烷中存在两种等效氢原子,所有C3H7Br有2种同分异构体;
C.C5H10可以是烯烃,也可以是环烷烃;
D.乙烷只有一种氢原子.
【解答】解:A.C6H6可以是链状结构,有多种异构体,如含三键的有:HC≡C﹣C≡C﹣CH2﹣CH3或HC≡C﹣CH2﹣C≡C﹣CH3或HC≡C﹣CH2﹣CH2﹣C≡CH或CH3﹣C≡C﹣C≡C﹣CH3,还有含双键和三键的等,也可以是环状结构为苯,故A错误;
B.C3H7Br中,由于丙烷分子中存在两种等效氢原子,所以C3H7Br存在两种同分异构体,故B错误;
C.C5H10可以是烯烃,也可以是环烷烃,存在同分异构体,故C错误;
D.乙烷只有一种氢原子,C2HCl5只有一种结构,故D正确.
故选D.
下列实验能获得成功的是( )
A.苯、溴水、铁粉混合制成溴苯
B.甲烷与氯气光照制得纯净的一氯甲烷
C.乙烯通入溴的四氯化碳溶液得到1,2﹣二溴乙烷
D.用高锰酸钾溶液除去乙烷中的乙烯杂质
知识点:烷烃
C
【考点】化学实验方案的评价.
【分析】A.苯和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯;
B.甲烷和氯气在光照条件下发生取代反应生成多种氯代烃;
C.乙烯和溴发生加成反应;
D.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳.
【解答】解:A.苯和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯,苯和溴水不反应,故A错误;
B.甲烷和氯气在光照条件下发生取代反应生成多种氯代烃,所以得不到纯净物,故B错误;
C.乙烯中还有碳碳双键,性质较活泼,乙烯和溴发生加成反应生成1,2﹣二溴乙烷,故C正确;
D.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,应该用溴水除去乙烷中的乙烯,故D错误;
故选C.
下列说法不正确的是( )
A.HF的热稳定性很好,是因为HF分子间存在氢键
B.构成单质分子的粒子之间不一定存在共价键
C.由非金属元素组成的化合物不一定是共价化合物
D.阴、阳离子间通过离子键一定能形成离子化合物
知识点:化学键
A
【考点】化学键.
【分析】A、稳定性是化学性质,而氢键是决定物理性质;
B、如稀气体之间不存任何化学键;
C、氯化铵是由非金属元素组成,而氯化铵是共价化合物;
D、离子键是阴阳离子之间形成的化学键.
【解答】解:A、稳定性是化学性质,而氢键是决定物理性质,而氟化氢稳定是氢氟键的键能大,故A错误;
B、如稀气体之间不存任何化学键,所以构成单质分子的粒子之间不一定存在共价键,故B正确;
C、氯化铵是由非金属元素组成,而氯化铵是共价化合物,所以由非金属元素组成的化合物不一定是共价化合物,故C正确;
D、离子键是阴阳离子之间形成的化学键,故D正确;
故选A.
在有机物的反应中,我们又学习到了新的反应类型,如取代反应,加成反应等,下列对反应类型的描述正确的是( )
A.苯与浓硝酸在浓硫酸作用下共热至50~60℃属于加成反应
B.乙烯通入溴水中,使溴水褪色属于取代反应
C.苯在一定条件和氢气反应,属于加成反应
D.乙烯和水在一定条件下反应生成乙醇属于氧化反应
知识点:烯烃
C
【考点】有机物的结构和性质;有机化学反应的综合应用.
【分析】A.苯与浓硝酸在浓硫酸作用下共热至50~60℃生成硝基苯;
B.乙烯与溴水发生加成反应生成1,2﹣二溴乙烷;
C.苯与氢气发生加成反应生成环己烷;
D.乙烯与水发生加成反应生成乙醇.
【解答】解:A.苯与浓硝酸在浓硫酸作用下共热至50~60℃生成硝基苯,苯中H被硝基取代,为取代反应,故A错误;
B.乙烯与溴水发生加成反应生成1,2﹣二溴乙烷,碳碳双键转化为单键,为加成反应,故B错误;
C.苯与氢气发生加成反应生成环己烷,为加成反应,故C正确;
D.乙烯与水发生加成反应生成乙醇,碳碳双键转化为﹣OH,为加成反应,故D错误;
故选C.
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
A.
3
5
12
20
B.
1
4
5
15
C.
1
2
11
19
D.
8
10
17
36
知识点:元素周期律与元素周期表
D
【考点】元素周期表的结构及其应用.
【分析】根据元素周期表的结构:相邻两个周期同主族元素的原子序数相差2、8、18、36来分析.
【解答】解:A、3号和5号元素之间相差很多个族,即12号的镁和13号的铝在周期表中不相邻,故A错误;
B、5号和15号元素的原子不在同一主族,故B错误;
C、1号和11好中间还有3号元素,故C错误.
D、O、Cl、Ne的位置关系是正确的,故D正确.
故选D.
下列物质中,在一定条件下既能进行加成反应,也能进行取代反应,但是不能使KMnO4酸性溶液褪色是
( )
A.乙烷 B.乙烯 C.甲苯 D.苯
知识点:烷烃
D
【考点】苯的性质;乙烯的化学性质;苯的同系物.
【分析】苯环中的碳碳键位于单双建之间,是一种独特的化学键,既能发生加成反应,又能起取代反应,但不能使KMnO4酸性溶液褪色,乙烷不能发生加成反应,乙烯和甲苯都能使KMnO4酸性溶液褪色,据此进行判断.
【解答】解:A、乙烷不含不饱和键,不能发生加成反应,也不能使KMnO4酸性溶液褪色,故A错误;
B、乙烯含有C=C键,能发生加成反应,并能使KMnO4酸性溶液褪色,故B错误;
C、甲苯分子中侧链受苯环影响,变得比较活泼,能够使高锰酸钾溶液褪色,故C错误;
D、苯环中的碳碳键位于单双建之间,是一种独特的化学键,既能发生加成反应,又能起取代反应,但不能使KMnO4酸性溶液褪色,故D正确;
故选D.
下列关于卤族元素的叙述,不正确的是( )
A.单质的颜色随核电荷数的增加逐渐加深
B.氢化物的稳定性随核电荷数的增加逐渐减弱
C.单质与水反应均可表示为X+H2O=HX+HXO
D.随核电荷数的增加卤素原子的半径递增,卤素离子的还原性增强
知识点:化学
C
【考点】卤素原子结构及其性质的比较.
【分析】卤族元素由上到下,非金属性减弱,以此比较单质的氧化性、气态氢化物的稳定性、阴离子的还原性;卤族元素由上到下,颜色加深、单质的沸点升高,而气态氢化物中HF中含氢键,沸点较高,以此来解答.
【解答】解:A、卤族元素由上到下,单质的颜色是逐渐加深的,依次是浅黄绿色﹣黄绿色﹣红棕色﹣紫红色,故A正确;
B、卤族元素由上到下,非金属性减弱,气态氢化物的稳定性减弱,故B正确;
C、Cl、Br、I单质与水反应可表示为 X2+H2O=HX+HXO,氟气和水之间反应生成的是HF和氧气,故C错误;
D、随核电荷数的增加,X﹣的电子层数逐渐增多,半径递增,离子的还原性递增,故D正确.
故选C.
下列烷烃中,能由相应的烯烃与H2按物质的量1:1加成制得,并且烯烃的种类有两种的是( )
A. B.
B.
C. D.
D.
知识点:化学
A
【考点】烯烃.
【分析】加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.根据加成原理采取逆推法还原C=C双键,烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置.
【解答】解:A、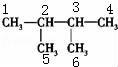 中在1号和2号碳原子间、2号和5号碳原子间可以存在双键,故A正确;
中在1号和2号碳原子间、2号和5号碳原子间可以存在双键,故A正确;
B、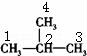 中能存在双键的位置只有一个,故B错误;
中能存在双键的位置只有一个,故B错误;
C、 中只能在3号和4号碳原子之间可以存在双键,故C错误;
中只能在3号和4号碳原子之间可以存在双键,故C错误;
D、 中任何两个碳原子间均不能存在双键,故D错误.
中任何两个碳原子间均不能存在双键,故D错误.
故选A.
同一主族的两种元素的原子序数之差不可能是( )
A.16 B.26 C.46 D.36
知识点:化学
C
【考点】元素周期表的结构及其应用.
【分析】相邻两个周期同主族元素的原子序数相差2、8、18、32,以此判断.
【解答】解:A.如0族中第一周期与第三周期元素相差16,故A不选;
B.如ⅣA等第二周期与第四周期元素相差26,故B不选;
C.2、8、18、32的组合不能得到46,则同主族原子序数之差不可能是46,故C选;
D.如零族等第三周期与第五周期元素相差36,故D不选;
故选C.
大多数的有机物都易燃,现有如下四种物质,当质量相同的时候,在足量氧气中完全燃烧时,消耗氧气量最多的是( )
A.苯 B.乙烯 C.异丁烷 D.新戊烷
知识点:化学
C
【考点】化学方程式的有关计算.
【分析】等质量时,有机物含氢量越大,燃烧时消耗氧气越多,由此分析解答.
【解答】解:等质量时,有机物含氢量越大,燃烧时消耗氧气越多,苯中碳氢的原子个数之比为:1:1;乙烯碳氢的原子个数之比为:1:2;异丁烷碳氢的原子个数之比为:1:2.5;新戊烷碳氢的原子个数之比为:1:2.4;综上所述异丁烷含氢量最大,等质量时,消耗O2最多,故选C.
下列说法正确的是( )
A.SiH4比CH4稳定
B.S2﹣半径比Cl﹣的小
C.7834Se和8034Se互为同素异形体
D.非金属性:O>N>P>Si
知识点:化学
D
【考点】元素周期律的作用.
【分析】A.元素非金属性越强,氢化物越稳定;
B.具有相同电子层排布的离子,质子数越多,半径越小;
C.同一种元素的不同核素,互为同位素;
D.同周期从左到右,非金属性逐渐增强,同周期自上而下,非金属性逐渐减弱.
【解答】解:A.非金属性C>Si,所以稳定性CH4>SiH4,故A错误;
B.S2﹣和Cl﹣具有相同电子层排布的离子,质子数越多,半径越小,所以S2﹣半径比Cl﹣的大,故B错误;
C.7834Se和8034Se是同一种元素的不同核素,互为同位素,故C错误;
D.同周期从左到右,非金属性逐渐增强,非金属性O>N、P>Si,同周期自上而下,非金属性逐渐减弱,所以非金属性N>P,故D正确;
故选D.
一种气态烷烃和气态烯烃组成的混合物18g,混合气体的密度是相同状况下氢气密度的11.2倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4g,组成该混合气体的成分可能是( )
A.甲烷和乙烯 B.甲烷和丙烯 C.乙烷和乙烯 D.甲烷和丁烯
知识点:化学
B
【考点】化学方程式的有关计算.
【分析】根据混合气体的密度是相同状况下H2密度的11.2倍可以确定有机物的平均摩尔质量22.4g/mol,故混合气体中一定有甲烷,混合气体的总的物质的量为: =0.8mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为9.6g,物质的量为0.6mol,故烯烃的物质的量为0.2mol,结合烯烃的质量和物质的量来确定烯烃的摩尔质量,再根据烯烃组成通式确定烯烃.
=0.8mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为9.6g,物质的量为0.6mol,故烯烃的物质的量为0.2mol,结合烯烃的质量和物质的量来确定烯烃的摩尔质量,再根据烯烃组成通式确定烯烃.
【解答】解:混合气体的密度是相同状况下H2密度的11.2倍可以确定有机物的平均摩尔质量22.4g/mol,故混合气体中一定有甲烷,混合气体的总的物质的量为: =0.8mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为9.6g,物质的量为0.6mol,故烯烃的物质的量为0.2mol,所以M(烯烃)=
=0.8mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为9.6g,物质的量为0.6mol,故烯烃的物质的量为0.2mol,所以M(烯烃)=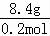 =42g•mol﹣1,
=42g•mol﹣1,
设烯烃的组成为CnH2n,则:14n=42,解得:n=3,故该烯烃为丙烯,
所以该混合物为甲烷、丙烯,
故选B.
原子序数为x的元素位于周期表中的第ⅡA族,则原子序数为x+1的元素不可能处在( )
A.ⅢA族 B.ⅠA族 C.镧族元素 D.ⅢB族
知识点:化学
B
【考点】元素周期表的结构及其应用.
【分析】短周期时,原子序数为x的元素位于周期表中的第ⅡA族,原子序数为x+1的元素在第ⅢA族,在四、五周期时,元素在ⅢB族,在六、七周期时,为镧系或锕系元素,以此来解答.
【解答】解:短周期时,原子序数为x的元素位于周期表中的第ⅡA族,原子序数为x+1的元素在第ⅢA族;
在四、五周期时,原子序数为x的元素位于周期表中的第ⅡA族,则原子序数为x+1的元素在ⅢB族;
在六、七周期时,原子序数为x的元素位于周期表中的第ⅡA族,则原子序数为x+1的元素为镧系或锕系元素,
则不可能为ⅠA族元素,
故选B.
四种主族元素的离子aXm+、bYn+、cZn﹣和dRm﹣(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )
①a﹣b=m﹣n
②元素的原子序数b>a>d>c
③元素金属性X>Y
④最高价氧化物对应水化物的碱性Y>X.
A.②③ B.③ C.①④ D.①②③
知识点:化学
C
【考点】原子结构与元素的性质.
【分析】四种短周期元素的离子aXm+、bYn+、cZn﹣和dRm﹣具有相同的电子层结构,则a﹣m=b﹣n=c+n=d+m,若m>n,故原子序数大小顺序是:a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,在同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的金属性随着原子序数的增大而减小,元素的金属性越强,其最高价氧化物的水化物碱性越强,据此答题.
【解答】解:四种短周期元素的离子aXm+、bYn+、cZn﹣和dRm﹣具有相同的电子层结构,则a﹣m=b﹣n=c+n=d+m,若m>n,故原子序数大小顺序是a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,
①离子aXm+、bYn+具有相同的电子层结构,则离子具有相同的电子数,即a﹣m=b﹣n,则a﹣b=m﹣n,故①正确;
②由题意可知,具有相同的电子层结构,根据阴前阳后,X、Y在下一周期,Z、R在上一周期,若m>n,则Y在X的前面,R在Z的前面,所以元素的原子序数为a>b>c>d,故②错误;
③X、Y为同一周期金属元素,在同一周期元素金属性从左向右逐渐减弱,即金属性:X<Y,故③错误;
④四种主族元素中X、Y为下一周期的金属元素,且元素的原子序数a>b,在同一周期元素的金属性从左向右在减弱,即金属性Y>X,则最高价氧化物对应水化物碱性Y>X,故④正确;
故选C.
某同学写出的下列烷烃的名称中,不正确的是( )
A.2,3﹣二甲基丁烷 B.2,5﹣二甲基﹣4﹣乙基己烷
C.2﹣甲基﹣3﹣乙基戊烷 D.2,2,3,3﹣四甲基丁烷
知识点:化学
B
【考点】有机化合物命名.
【分析】依据烷烃命名原则分析判断:
①长﹣﹣﹣﹣﹣选最长碳链为主链;
②多﹣﹣﹣﹣﹣遇等长碳链时,支链最多为主链;
③近﹣﹣﹣﹣﹣离支链最近一端编号;
④小﹣﹣﹣﹣﹣支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近﹣﹣﹣﹣﹣离支链最近一端编号”的原则;
⑤简﹣﹣﹣﹣﹣两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
【解答】解:A.此烷烃在主链上有4个碳原子,在2号和2号碳原子上各有一个甲基,故名称为:2,3﹣二甲基丁烷,故A正确;
B.取代基的位次和最小,应为2,5﹣二甲基﹣3﹣乙基己烷,故B错误;
C.烷烃命名时,要选最长的碳链为主链,故此烷烃中主链上有5个碳原子,从离支链近的一端给主链上碳原子编号,当两端离支链一样近时,要从支链多的一端开始编号,当两端支链一样多是,要从支链简单的一端开始编号,故在2号碳原子上有一个甲基,在3号碳原子上有一个乙基,故名称为:2﹣甲基﹣3﹣乙基戊烷,故C正确;
D.烷烃命名时,要选最长的碳链为主链,故在主链上有4个碳原子,从离支链近的一端给主链上碳原子编号,而两端离支链一样近,且支链一样多,故在2号碳原子、3号碳原子上各有两个甲基,故名称为:2,2,3,3﹣四甲基丁烷,故D正确.
故选B.
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在agHmX中所含质子的物质的量是( )
A. B.
B. (A﹣N) mol
(A﹣N) mol
C. (A﹣N) mol D.
(A﹣N) mol D. (A﹣N+m) mol
(A﹣N+m) mol
知识点:化学
D
【考点】物质的量的相关计算;质量数与质子数、中子数之间的相互关系.
【分析】根据质子数=质量数﹣中子数计算X原子质子数,进而计算每个HmX分子含有质子数,根据n= 计算HmX的物质的量,结合每个分子含有质子数计算.
计算HmX的物质的量,结合每个分子含有质子数计算.
【解答】解:某元素的一种同位素X的原子质量数为A,含N个中子,则质子数为(A﹣N),则每个HmX分子含有质子数为(A﹣N+m),ag HmX的物质的量为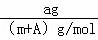 =
=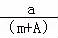 mol,故含有质子物质的量为
mol,故含有质子物质的量为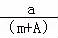 mol×(A﹣N+m)=
mol×(A﹣N+m)=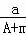 (A﹣N+m) mol,故选D.
(A﹣N+m) mol,故选D.
下列各组化合物中,不论二者以任何比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量不变的是( )
A.CH4、C2H6 B.C2H6、C3H6 C.C2H4、C3H6 D.C2H4、C3H4
知识点:化学
C
【考点】化学方程式的有关计算.
【分析】无论以何种比例混合,只要混合物的总质量一定,完全燃烧时消耗O2的质量不变,说明混合物各烃的最简式相同,完全燃烧生成H2O的质量也一定,则说明混合物各烃分子中含氢量相等,故混合物中各烃满足最简式相同即可.
【解答】解:A、CH4最简式为CH4,C2H6最简式为CH3,二者最简式不同,故A不符合;
B、C2H6最简式为CH3,C3H6最简式为CH2,二者最简式不同,故B不符合;
C、C2H4最简式为CH2,C3H6最简式为CH2,二者最简式相同,故C符合;
D、C2H4最简式为CH2,C3H4最简式为C3H4,二者最简式不同,故D不符合;
故选C.