下列措施不符合节能减排的是( )
A.大力发展火力发电,解决广东电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
知识点:化学与社会的相互关系
A
略
把 X气体和Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g) ![]() nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
A.1 B.2 C.3 D.4
知识点:化学反应速率和化学平衡
A
略
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( )
A.加入一种反应物 B.升高温度 C.对平衡体系增加压强 D.使用催化剂
知识点:化学平衡状态及移动
B
略
0.5 mol CH4完全燃烧生成CO2和液态H2O时,放出445 kJ的热量,则下列热化学方程式中正确的是 ( )
A.CH4(g)+2O2(g)=CO2(g)+4H2O(g) ΔH=-890 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol
D.![]() CH4(g)+O2(g)=
CH4(g)+O2(g)=![]() CO2(g)+H2O(l) ΔH=-890 kJ/mol
CO2(g)+H2O(l) ΔH=-890 kJ/mol
知识点:化学反应的热效应
C
略
已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O;ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol ks5u
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为114.6 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
知识点:化学反应的热效应
A
略
在25℃时,向纯水中加入少量的KHSO4固体,则( )
A.溶液的pH升高 B.水的离子积常数Kw减小
C.水的电离平衡向正方向移动 D.溶液的酸性增强
知识点:电解质溶液
D
略
在一密闭容器中,反应3A(g)+B(s) ![]() 2C(g)+2D(g) ΔH
>0达到平衡后,改变以下条件,下列说法正确的是(
)
2C(g)+2D(g) ΔH
>0达到平衡后,改变以下条件,下列说法正确的是(
)
A.增大压强,正、逆反应速率同等程度增大,平衡不移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
C.增加A的浓度,平衡向正方向移动,平衡常数增大
D.增加B的用量,正、逆反应速率不变,平衡不移动
知识点:化学平衡状态及移动
D
略
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+,对于该平衡,下列叙述正确的是 ( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol ·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
知识点:弱电解质的电离
B
略
.室温下,等体积的、pH=2的 HCl和CH3COOH溶液,以下说法正确的是 ( )
A.两溶液中由水电离的c(H+)前者小于后者
B.两溶液分别和足量的锌反应,生成氢气的体积相等
C.两溶液分别和相同的锌反应,生成氢气的起始速率相等
D.两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,都呈中性
知识点:弱电解质的电离
C
略
右图中的曲线是表示其他条件一定时,2NO(g)+O2(g)
![]() 2NO2(g)△H<0反应中NO2的百分含量与温度的关系
2NO2(g)△H<0反应中NO2的百分含量与温度的关系
曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,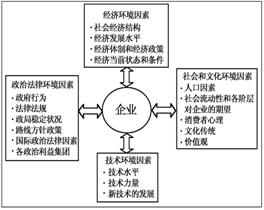
且v(正)>v(逆)的点是 ( )
A.a点 B.b点 C.c点 D.d点
知识点:化学平衡状态及移动
C
略
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )
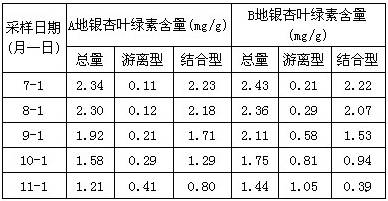
A.③②① B.③①② C.①②③ D.②①③
知识点:化学平衡状态及移动
A
略
已知:4NH3(g)+5O2(g)
![]() 4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
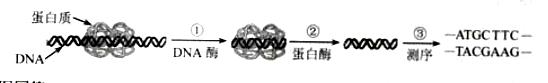

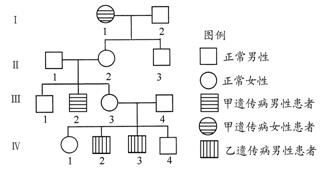
知识点:化学平衡状态及移动
C
略
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0)。某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0)。某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为QkJ
C.将反应的温度由T1升高至T2,则反应的平衡常数K1>K2
D.当反应吸收热量为0.25QkJ时,生成的HCl恰好与1 molNaOH反应
知识点:化学反应与能量的变化
D
略
下图表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )

A.等质量的白磷与红磷充分燃烧,红磷放出的热量多
B.红磷比白磷稳定
C.白磷转化为红磷是放热反应ks5u
D.红磷比白磷更容易与氧气反应生成P4O10
知识点:化学反应与能量的变化
BC
略
在一定温度下的定容密闭容器中,以下说法能表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.混合气体的压强不变 B.混合气体的密度不变
C.每消耗2molB,同时消耗1molC D.C和D的浓度比不变
知识点:化学平衡状态及移动
CB
略
.在一定温度下,向容积固定不变的密闭容器里充入a mol N2O4发生如下反应:N2O4 (气) ![]() 2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是 ( )
2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是 ( )
A.平均相对分子质量增大 B.N2O4的转化率提高
C.压强为原来的2倍 D.颜色变深
知识点:化学平衡状态及移动
AD
略
常温下,由水电离出的c(OH-)=1×10-13mol/L的溶液中,可能大量共存的离子组是( )
A.Cl-、NH4+、Na+、K+ B.Fe3+、CH3COO-、K+、Ba2+
C.CO32—、SO42—、Cl-、Na+ D.NH4+、Mg2+、HCO3—、Cl-
知识点:离子共存
AC
略
pH=2的A、B两种酸溶液各1 mL,分别加水稀释
 到1 000 mL,其中pH与溶液体积V的关系如右图所
到1 000 mL,其中pH与溶液体积V的关系如右图所
示,下列说法正确的是( )
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都是弱酸,则5>a>2
知识点:弱电解质的电离
CD
略
下列装置或操作能达到目的的是
 ①
②
③
④
①
②
③
④
A.装置①依据两容器内气体颜色变化,判断反应2NO2(g)![]() N2O2(g)平衡移动的方向
N2O2(g)平衡移动的方向
B.装置②依据U管两边液面的高低判断Na和水反应的热效应
C.装置③测定中和热
D.装置④依据褪色快慢比较浓度对反应速率的影响
知识点:综合性实验
AB
略
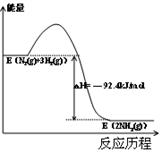
.(13分)工业上合成合成氨的热化学方程式如下:
N2(g) + 3H2(g) ![]() 2NH3(g) △H = —92.4 kJ/mol
2NH3(g) △H = —92.4 kJ/mol
(1)请在答卷上画出以上反应过程中体系的能量变化图(进行必要的标注)。
(2)工业上采取以下措施能用勒夏特列原理解释的是
A.加入催化剂 B.增大反应容器的压强(50MPa)
C.升高反应的温度(5000C) D.设法分离产生的氨气
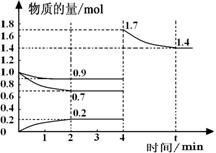
(3)一定温度下,在密闭容器中进行以上反应。容器中0—4minN2、H2和NH3三种气体的物质的量随时间的变化曲线如图所示。

①若容器为体积为2L的恒容容器,则反应开始2分钟 NH3的平均反应速率为______。
②若容器为体积可变的恒压容器,在4min时往容器中再加入N2和H2各1mol,平衡向 移动(填“向右”、“向左”或“不”),平衡常数 (填“增大”、“减小”或“不变”);反应一段时间后,在t min时再次达到平衡,在答卷的图中画出H2在4min—t min时间内物质的量的变化曲线(标出必要数据)。
知识点:化学平衡状态及移动
(13分)
(1)(3分,坐标轴名称、曲线、能量表示各1分) (2)BD (2分)
(3)①0.05mol/(L·min)(2分)
②向右(2分) 不变(2分) 画图(2分,曲线、数据各1分)
略
(15分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+ 2CO![]() 2CO2+ N2。请回答下列问题:
2CO2+ N2。请回答下列问题:
(1)在上述条件下反应能够自发进行,则反应的![]() 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。
(2)该反应的平衡常数表达式为 。
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验
编号
T/0C
NO初始浓度/mol·L-1
CO初始浓度/mol·L-1
催化剂的比表面积/m2·g-1
I
280
1.2×10-3
5.8×10-3
82
II
124
III
350
124
①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的II、III两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。

知识点:化学平衡状态及移动
(15分)
(1)<(2分) (2)K=![]() (2分) (3)CD(2分)
(2分) (3)CD(2分)
![]() (4)①II: 280、1.2×10-3、5.8×10-3
(4)①II: 280、1.2×10-3、5.8×10-3![]() III:1.2×10-3 、5.8×10-3(5分,各1分)
III:1.2×10-3 、5.8×10-3(5分,各1分)
![]() ②
②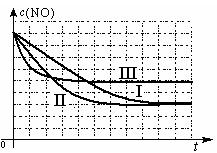 (4分,每条曲线和编号各1分)
(4分,每条曲线和编号各1分)
略
(11分)CO是对环境影响较大的气体,对它的合理控制和治理是优化我们生存环境的有效途径。
(1)工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:___________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+
CO(g)![]() CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的![]() ,据此计算该温度下反应的平衡常数(写出计算过程)。
,据此计算该温度下反应的平衡常数(写出计算过程)。
(3)在恒温恒容的条件下,向(2)达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡 。
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断是否移动
知识点:化学反应速率和化学平衡
(11分)
(1)2H2(g)+CO(g) = CH3OH(l) ΔH = +131.9 kJ/mol(3分)
(2)设平衡时CO转化x mol•L-1(1分)
2H2(g) + CO(g) ![]() CH3OH(l)
CH3OH(l)
起始时各物质浓度/ mol•L-1 1.5 1 0
平衡时各物质浓度/ mol•L-1 1.5-2x 1-x x (2分)
依题意有![]() (1分) x=0.5
(1分)
(1分) x=0.5
(1分)
![]() (1分)ks5u
(1分)ks5u
(3)C (2分)
略
(9分)常温下,取两片质量相等、外形和组成相同表面经过砂纸打磨(完全除掉了氧化物)的铝片,分别加入到盛有体积相同、c(H+)相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中制取H2。实验现象如下表:
时间
酸
1 min
2 min
5 min
15 min
20 min
实验一:3mol/L 盐酸
少量气泡
较多气泡
大量气泡
反应剧烈
铝片耗尽
实验二:1.5mol/L 硫酸
均无明显现象(无气泡)
(1)写出以上反应的离子方程式_____________________________________;
(2)分析上表数据,你得出的结论是: ;
(3)对你以上的结论可能的原因提出假设(写出一个即可):
_________________________________________________________________ ;
(4)请设计实验对你的假设进行验证:
____________________________________________________________________。
知识点:化学反应速率
(9分)
(1)2Al+6H+==2Al3++3H2↑ (2分)ks5u
(2)Al在c(H+)相同的盐酸中反应比在硫酸中快得多(2分)
(3)Cl-对铝与H+反应有促进作用(或SO42-对铝与H+反应有抑制作用)(2分)
(4)取适量以上稀硫酸(1分),加入少量的氯化钠(或氯化钾等其他可溶性氯化物)固体(1分),重复实验二,若反应速率加快(1分),则假设成立;(3分)
(或取适量以上稀盐酸,加入少量的硫酸钠(或硫酸铵等其他可溶性硫酸盐)固体,重复实验一,若反应速率减慢,则假设成立)。ks5u
略