化学与生产、生活密切相关。下列叙述正确的是
A.煤的干馏和石油的分馏均属化学变化
B.BaSO4在医学上用作钡餐,Ba2+对人体无毒
C.![]() 可用于文物年代的鉴定,
可用于文物年代的鉴定,![]() 与
与![]() 互为同素异形体
互为同素异形体
D.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
知识点:化学与科学
D
略
NA为阿伏加德罗常数,下列叙述正确的是[M(Fe)=56]
A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
B.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
C.5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA
D.1mol过氧化氢分子中共用电子对数为3NA
知识点:物质的量的计算
D
略
下列说法正确的是
A.醋酸纤维、橡胶、腈纶都属于合成高分子化合物
B.加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖
C.油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂
D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯
知识点:有机化学知识综合应用
B
略
常温下,下列各组离子在指定溶液中能大量共存的是
A.![]() 的溶液中
的溶液中
:![]() 、
、![]() 、
、![]() 、
、![]()
B.由水电离的![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
知识点:离子共存
C
略
下列关于铜电极的叙述正确的是
A.铜锌原电池中锌是正极
B.用电解法精炼粗铜时用纯铜作阳极
C.在镀件上电镀铜时应将镀件作阴极
D.电解稀硫酸制H2、O2时铜与电源正极相连
知识点:电化学基础
C
略
已知A、B、C、D、E是短周期元素,原子序数依次增大。其中A、E的单质在常温下呈气态, B的原子最外层电子数是其电子层数的2倍, C在同周期主族元素中原子半径最大, D的合金是日常生活中常用的金属材料。下列说法正确的是
A.B位于元素周期表中第二周期第VIA族
B.工业上常用电解法制备C、D、E的单质
C.C、D的最高价氧化物对应的水化物之间能发生化学反应
D.化合物AE与CE具有相同类型的化学键
知识点:元素周期律与元素周期表
BC
略
关于浓度均为0.1 mol/L的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是
A.c(CH3COO-):③>①
B.水电离出的c(OH-):②>①
C.①和②等体积混合后的溶液: c(OH![]() )=c(H+)+ c(CH3COOH)
)=c(H+)+ c(CH3COOH)
D.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH![]() )
)
知识点:离子浓度比较
BD
略
链接化学是指利用易得的原料,通过高效、可靠而又具有选择性的反应来实现杂原子连接(C—X—C),低成本、快速地合成新化合物的一套实用的合成方法。中国科学家王臻等采用链接化学的策略,制备了三氮唑连接的多聚萨伦锰(Ⅲ)(Salen-Mn(Ⅲ))催化剂,此类聚合配体的金属络合物对苯乙烯环氧化反应有很好的催化性能。制备过程如下:
 (1)化合物Ⅱ的分子式为_________;写出化合物Ⅱ含氧官能团的名称___________。
(1)化合物Ⅱ的分子式为_________;写出化合物Ⅱ含氧官能团的名称___________。
(2)下列有关化合物Ⅱ的说法正确的是
A.化合物Ⅱ属于炔烃,最多能够与6mol氢气发生加成反应
B.化合物Ⅱ属于酚类,能够遇FeCl3溶液而显色
C.化合物Ⅱ属于醛类,1 mol化合物Ⅱ可以发生银镜反应生成2 mol Ag
D.化合物Ⅱ能够与浓溴水反应,可以发生加成反应,但不能发生取代反应
(3)上述反应的反应类型分别是:①__________②___________③____________
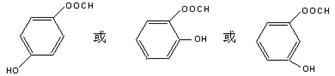
(4)①化合物I含有酚羟基又能发生水解反应的同分异构体有多种,请写出其中一种的结构简式:______________________;
②两种反应物以1∶1发生反应①时还可能生成另外一种副产物,该副反应的化学反应方程式为:_______________________________;
(5)在上述制备过程中,起到链接作用的化合物是___________________________。
知识点:有机合成及高分子化合物
(1)C10H8O3
醛基、羟基(或酚羟基)、醚键(醚键不写不扣分)
(2)BC
(3)取代反应、加成反应、缩聚反应
(4)

(5)![]() (题干文字中有提示)
(题干文字中有提示)
略
Ⅰ.在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g);△H<0
2NH3(g);△H<0
反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
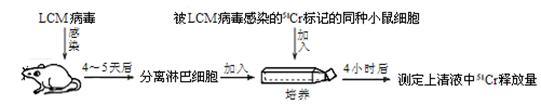
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为 。
(2)若容器容积不变,下列措施可增加NH3产率的是 。
A.升高温度
B.将NH3(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.2molN2和0.6molH2
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡向 移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数 (填“增大”、“减少”或“不变”)。
Ⅱ.常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH
值的变化关系如右图所示。
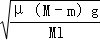
(4) a >7.0的理由是(用离子方程式表示)
(5)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka(设混合后的体积为二者的体积之和,计算结果保留两位有效数字,写出计算过程)。
知识点:化学平衡状态及移动
(1)![]()
(2)B D
(3)向正反应方向;不变
(4)CH3COO-
+ H2O![]() CH3COOH + OH-
CH3COOH + OH-
(5)解:当加入盐酸的体积为20.0mL时,两种物质刚好完全反应,生成c(CH3COOH) = 0.10mol/L
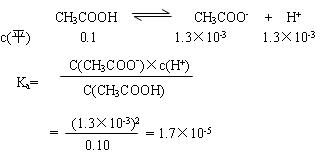
略
检验海带中碘的检验的实验步骤为:
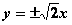
(1)第②步为了加快溶解速度并使含碘离子充分进入溶液,可以采取的措施是_______________________;_________________________(写出两条)。
(2)第③步操作中需使用的玻璃仪器有烧杯、 和 。
(3)某学习小组拟通过实验探究某食盐样品中是否加碘及所加碘的存在形式是I2、I-、IO3-中的哪一种。请利用实验室常用仪器、用品和下列限选试剂完成探究过程。
限选试剂:浓硫酸、1.0mol/LHNO3、1.0mol/L HCl、1.0mol/LCH3COOH、0.1mol/LAgNO3、1.0mol/LNaHSO3、1.0mol/LKI、3%H2O2、1%淀粉溶液、蒸馏水
查阅资料知:2IO3-+5HSO3-=I2+5SO42-+H2O+3H+
①提出合理假设。
假设1:该食盐样品中含I2
假设2:
假设3
假设4:该食盐样品不含碘
②设计实验方案证明你的假设(不要在答题卡上做答)
③实验过程
根据②设计方案证明你的假设。在答题卡中按下表格式写出实验步骤、预期现象与结论。
实验步骤
预期现象与结论
步骤1:取食盐样品约2g置于表面皿中,滴入3滴淀粉溶液
若显蓝色,则假设1成立。若不显蓝色,则进行步骤2
步骤2:
步骤3:
……
知识点:综合性实验
(1)加热 搅拌 适当延长浸取时间 少量溶剂多次浸取(答其中任意两个即可)
(2)玻璃棒 (普通)漏斗
(3)①假设2:食盐中含I-。假设3:食盐中含IO3-
|
实验步骤 |
预期现象与结论 |
|
-------------------------------- |
------------------------------- |
|
步骤2:取食盐样品2g置于表面皿中,滴入几滴1.0mol/LCH3COOH溶液和3-4滴3%H2O2后,滴入3滴淀粉溶液 |
若溶液显蓝色,假设2成立,若不显蓝色,则进行步骤3。 |
|
步骤3:取食盐样品2g置于表面皿中,滴入几滴NaHSO3溶液,再滴入3滴淀粉溶液 |
若溶液显蓝色,则假设3成立;若不显蓝色结合步骤2、3中未见蓝色溶液的现象可判断该食盐样品不含碘。 |
略