19世纪中叶,门捷列夫的突出贡献是()
A.提出原子学说 B.发现元素周期律
C.提出分子学说 D.发现氧气
知识点:元素周期律与元素周期表
B
考点:化学史;元素周期表的结构及其应用.
专题:元素周期律与元素周期表专题.
分析:1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循.
解答:解:A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.拉瓦锡发现氧气,故D错误.
故选B.
点评:本题考查化学史,熟记化学发展史中各科学家所作出的巨大贡献即可解答,较简单.
下列元素中,最高正化合价数值最大的是()
A.Cl B.O C.Mg D.Na
知识点:元素周期律与元素周期表
A
考点:常见元素的化合价;原子结构与元素的性质.
分析:元素的原子核外最外层电子数决定元素最高化合价,最外层电子数越多,化合价越大,根据最外层电子数判断最高化合价,一般主族元素最高正化合价等于其最外层电子数,而F元素没有最高正化合价,稀有气体化合价一般为0价,O的最高化合价为+2价.
解答:解:A.Cl的最外层电子数为7,最高化合价为+7价,
B.O的最外层电子数为6,但最高化合价为+2价,如OF2中的氧元素;
C.Mg的最外层电子数为6,最高化合价为+2价;
D.Na的最外层电子数为1,最高化合价为+1价;
则化合价最高的为Cl,
故选A.
点评:本题考查化合价的判断,题目难度不大,本题注意根据元素在周期表中的位置可判断最外层电子数,根据最外层电子数判断化合价,注意F元素没有最高正化合价,O的最高化合价为+2价.
下列各组物质中互为同位素的是()
A. Ca和
Ca和 Ar B.
Ar B. Cl和
Cl和 Cl
Cl
C.H2O和H2O2 D.O3和O2
知识点:化学用语
B
考点:同位素及其应用.
分析:质子数相同中子数不同的原子互称同位素.互为同位素原子具有以下特征:
质子数相同、化学性质相同、在周期表中的位置相同;
中子数不同、质量数不同、物理性质不同;
研究对象为原子.
解答:解:A.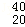 Ca和
Ca和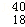 Ar质子数分别为:20、18,质子数不相同,故A错误;
Ar质子数分别为:20、18,质子数不相同,故A错误;
B.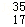 Cl和
Cl和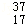 Cl质子数相同,中子数分别为18、20不同,互为同位素,故B正确;
Cl质子数相同,中子数分别为18、20不同,互为同位素,故B正确;
C.H2O和H2O2都是由氢氧元素组成的,不同水分子,属于化合物,不是原子,故C错误;
D.O2与O3都是由氧元素形成的结构不同的单质,互为同素异形体,故D错误;
故选B.
点评:本题考查同位素的判断,明确同位素、同素异形体等概念是解本题的关键,注意把握概念的理解,难度不大.
下列物质中含有非极性键的化合物是()
A.NaOH B.Na2O2 C.KCl D.HF
知识点:化学键
B
考点:极性键和非极性键.
分析:非极性键是同种非金属元素之间形成,极性键是不同种非金属元素之间形成的,注意题中要求是化合物不是单质,据此进行判断.
解答:解:A、氢氧化钠属于离子化合物,氢氧根离子中含有极性共价键,不含非极性共价键,故A错误;
B、过氧化钠中的过氧根离子,存在O﹣O非极性共价键,故B正确;
C、KCl中只有离子键,没有非极性键,故C错误;
D、HF中的H﹣F键属于极性共价键,不存在非极性共价键,故D错误;
故选B.
点评:本题考查了极性键和非极性键,难度不大,注意题中要求的是含有非极性键的化合物.
一种元素最高价态的氧化物的水化物的化学式为H3XO4,则X的氢化物的化学式是()
A.HX B.H2X C.XH3 D.XH4
知识点:原子结构与性质
C
考点:原子结构与元素的性质.
分析:元素的最高正价+|最低负价|=8,根据元素的最高价氧化物的水化物的化学式确定最高正价,进而求得最低负价,得出气态氢化物的化学式.
解答:解:元素X的最高价氧化物的水化物的化学式为H3XO4,所以X的最高正价是+5价,所以最低负价为﹣3价,X的气态氢化物的化学式为XH3.
故选:C.
点评:本题考查学生元素周期律的应用知识,注意把握元素的最高正价与负价的关系,题目较简单.
下列叙述中,正确的是()
A.离子化合物中不含共价键
B.共价化合物中不含离子键
C.非金属元素组成的化合物一定是共价化合物
D.非极性键不是化学键
知识点:化学键
B
考点:共价键的形成及共价键的主要类型;离子化 合物的结构特征与性质.
合物的结构特征与性质.
分析:A.离子化合物中可存在共价键;
B.含离子键的一定为离子化合物;
C.非金属元素组成的化合物可能为离子化合物;
D.非极性键属于共价键.
解答:解:A.离子化合物中可存在共价键,如NaOH中含离子键和共价键,故A错误;
B.含离子键的一定为离子化合物,则共价化合物中不含离子键,故B正确;
C.非金属元素组成的化合物可能为离子化合物,如铵盐为离子化合物,故C错误;
D.非极性键属于共价键,也属于化学键,故D错误;
故选B.
点评:本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是()
A.CO2的电子式
B.Cl﹣的结构示意图:
C.乙烯的结构简式C2H4
D.Z质量数为37的氯原子 Cl
Cl
知识点:化学用语
B
考点:电子式、化学式或化学符号及名称的综合.
分析:A.二氧化碳分子中含有两个碳氧双键;
B.氯离子的核电荷数为17,核外电子总数为18,最外层为8个电子;
C.乙烯的结构简式中漏掉了碳碳双键;
D.元素符号的左上角为质量数、左下角为质子数..
解答:解:A.二氧化碳为共价化合物,其分子中含有两个碳氧双键,其正确的电子式为: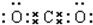 ,故A错误;
,故A错误;
B.氯离子的核电荷数为17,最外层达到8电子稳定结构,氯离子的结构示意图为: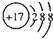 ,故B正确;
,故B正确;
C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;
D.氯元素的核电荷数=质子数=17,质量数为37的氯原子可以表示为:1737Cl,故D错误;
故选B.
点评:本题考查了常见化学用语的表示方法,题目难度中等,注意掌握离子结构示意图、电子式、结构简式、元素符号等化学用语的概念及书写原则,试题培养了学生规范答题的能力.
已知某粒子ZARn+,则元素R的原子序数是()
A.Z B.A﹣Z C.Z﹣n D.Z+n
知识点:原子结构与性质
A
考点:核素;质子数、中子数、核外电子数及其相互联系;质量数与质子数、中子数之间的相互关系.
专题:原子组成与结构专题.
分析:根据原子符号的含义以及质子数=原子序数=核电荷数来解答.
解答:解:由某粒子ZARn+,可知质子数为Z,而质子数=原子序数=核电荷数,所以元素R的原子序数Z,故选:A.
点评:本题主要考查了原子符号的含义以及质子数、原子序数、核电荷数的关系,难度不大.
已知某元素的原子序数,则不能推出该元素原子的()
A.质子数 B.中子数 C.电子数 D.核电荷数
知识点:原子结构与性质
B
考点:质量数与质子数、中子数之间的相互关系.
专题:原子组成与结构专题.
分析:根据原子中,质子数=原子序数=核电荷数=电子数,质量数=质子数+中子数来解;
解答:解:在原子中,质子数=原子序数=核电荷数=电子数,质量数=质子数+中子数,所以已知某元素的原子序数,则不能推出该元素原子的中子数,故选:B;
点评:本题考查学生原子原子中的质子数、中子数以及电子数之间的关系,可以根据所学知识 回答,较简单.
回答,较简单.
第三周期R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是()
A.Li B.S C.Si D.P
知识点:原子结构与性质
C
考点:原子核外电子排布.
分析:第三周期R元素的原子的次外层的电子数为最外层电子数的2倍,最外层不大于8个电子,次外层不大于18个电子,以此进行判断.
解答:解:A.Li原子核外各层电子分别为2、1,次外层的电子数为最外层电子数的2倍,但属于第二周期,故A错误;
B.S原子核外各层电子分别为2、8、6,次外层的电子数不为最外层电子数的2倍,故B错误;
C.Si原子核外各层电子分别为2、8、4,次外层的电子数为最外层电子数的2倍,属于第三周期,故C正确;
D.P原子核外各层电子分别为2、8、5,次外层的电子数不为最外层电子数的2倍,故D错误.
故选C.
点评:本题考查了原子核外电子的排布,难度不大,注意原子核外电子的排布时,每个电子层上最多排2n2个电子,但必须遵循“最外层不大于8个电子,次外层不大于18个电子,”的规则.
下列变化过程中,共价键被破坏的是()
A.烧碱固体溶于水 B.氯化氢气体溶于水
C.二氧化碳变成干冰 D.碘溶于酒精
知识点:化学键
B
考点:共价键的形成及共价键的主要类型.
专题:化学键与晶体结构.
分析:物质三态之间变化时只破坏分子间作用力,物质溶于水或者熔化时发生电离破坏化学键,以此来解答.
解答:解:A.烧碱固体溶于水发生电离生成钠离子和氢氧根离子,破坏的是钠离子与氢氧根离子间的离子键,氢氧根内部共价键未被破坏,故A错误;
B.氯化氢溶于水,氯化氢在水分子的作用下发生电离生成氯离子和氢离子,所以有共价键破坏,故B正确;
C.二碳变成干冰,是由气态转化为固态,只破坏分子间作用了,不破坏化学键,故C错误;
D.碘溶于酒精后,碘在酒精中以分子形式存在,所以没有化学键的破坏,故D错误;
故选B.
点评:本题考查了电解质的电离与学键的破坏,只有电解质溶于水或熔融状态发生电离,化学键才能被破坏.
下列不是离子化合物的是()
A.H2O B.CaI2 C.KOH D.NaNO3
知识点:化学键
A
考点:离子化合物的结构特征与性质.
分析:活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答:解:A.水分子中H﹣O原子之间只存在共价键,为共价化合物,故A选;
B.碘化钙中钙离子和碘离子之间只存在离子键,为离子化合物,故B不选;
C.KOH中钾离子和氢氧根离子之间存在离子键、O﹣H原子之间存在共价键,为离子化合物,故C不选;
D.硝酸钠中钠离子和硝酸根离子之间存在离子键、N﹣O原子之间存在共价键,为离子化合物,故D不选;
故选A.
点评:本题考查化学键和化合物的关系,侧重考查基本概念,明确离子化合物和共价化合物的区别是解本题关键,注意不能根据是否含有 金属元素判断离子键,题目难度不大.
金属元素判断离子键,题目难度不大.
(双选)下列关于铷(Rb)的叙述正确的是()
A.它位于周期表的第五周期,第I A族
B.氢氧化铷是弱碱
C.在钠、钾、铷3种单质中,铷的熔点最高
D.硝酸铷是离子化合物
知识点:钠和碱金属
AD
考点:碱金属的性质.
专题:金属概论与碱元素.
分析:A.Rb和K位于同一主族,且在K元素下一周期;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.金属晶体中,金属键越强其熔沸点越高,金属键与原子半径成反比;
D.活泼金属和酸根离子之间易形成离子键.
解答:解:A.Rb和K位于同一主族,且在K元素下一周期,所以Rb位于第五周期第IA族,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Rb>K,KOH是强碱,所以Rb也是强碱,故B错误;
C.金属晶体中,金属键越强其熔沸点越高,金属键与原子半径成反比,金属键Na>K>Rb,所以单质的熔沸点中钠最高,故C错误;
D.Rb是活泼金属,易和硝酸根离子之间形成离子键,所以硝酸铷是离子化合物,故D正确;
故选AD.
点评:本题以铷为载体考查碱金属元素,侧重考查同一主族元素性质递变规律及知识迁移能力,以钠、钾为例采用知识迁移的方法解答即可,题目难度不大.
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是()
A.原子半径A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C
D.阴离子还原性C3﹣>B2﹣>A﹣
知识点:元素周期律与元素周期表
A
考点:非金属在元素周期表中的位置及其性质递变的规律.
专题:元素周期律与元素周期表专题.
分析:同周期元素从左到右元素的非金属性逐渐增强,对应最高价氧化物对应水化物的酸性逐渐增强,同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则非金属性:A>B>C,原子序数:A>B>C,结合元素周期律的递变规律进行判断.
解答:解:同周期元素从左到右元素的非金属性逐渐增强,对应最高价氧化物对应水化物的酸性逐渐增强,同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则非金属性:A>B>C,原子序数:A>B>C,则
A.同周期元素原子半径从左到右原子半径逐渐减小,原子序数:A>B>C,则原子半径A<B<C,故A错误;
B.非金属性:A>B>C,非金属性越强,对应氢化物的稳定性越强,则有气态氢化物稳定性HA>H2B>CH3,故B正确;
C.非金属性越强,对应最高价氧化物对应水化物的酸性越强,已知酸性强弱顺序HAO4>H2BO4>H3CO4,则有非金属性A>B>C,故C正确;
D.非金属性越强,对应单质的氧化性越强,阴离子的还原性越弱,非金属性A>B>C,则有阴离子还原性C3﹣>B2﹣>A﹣,故D正确.
故选A.
点评:本 题考查同周期元素非金属性的递变,题目难度中等,注意比较非金属性的角度.
题考查同周期元素非金属性的递变,题目难度中等,注意比较非金属性的角度.
(双选)关于第三周期元素性质的说法正确的是()
A.镁单质能和冷水发生剧烈的反应
B.碱性Mg(OH)2>Al(OH)3
C.稳定性SiH4<HCl
D.金属 性Na<Mg
性Na<Mg
知识点:元素周期律与元素周期表
BC
考点:同一周期内元素性质的递变规律与原子结构的关系.
分析:A、镁表面打磨光亮的镁条在热水中可以发生剧烈反应,但与冷水微弱的反应;
B、金属性越强,最高价氧化物对应的水化物的碱性越强;
C、非金属性越强,元素氢化物的稳定性越强;
D、同周期从左到右金属性减弱.
解答:解:A、镁表面打磨光亮的镁条在热水中可以发生剧烈反应,但与冷水微弱的反应,故A错误;
B、金属性:Mg>Al,所以碱性Mg(OH)2>Al(OH)3,故B正确;
C、非金属性Si<Cl,所以稳定性SiH4<HCl,故C正确;
D、同周期从左到右金属性减弱,所以金属性Na>Mg,故D错误;
故选BC.
点评:本题考查同主族性质元素化合物性质的递变规律,题目难度不大,注意理解同主族元素化合物性质递变规律.
(双选)下列各组三种元素中,属于同一周期的是()
A.C、H、O B.F、Cl、Br C.Li、Be、B D.Si、S、P
知识点:元素周期律与元素周期表
CD
考点:元素周期表的结构及其应用.
专题:元素周期律与元素周期表专题.
分析:原子的核外电子层数相同时,则在元素周期表中位于同一周期,以此来解答.
解答:解:A、H只有1个电子层,而C、O有2个电子层,则不在同一周期,故A错误;
B、F有2个电子层,Cl有3个电子层,Br有4个电子层,则不在同一周期,故B错误;
C、Li、Be、B都有2个电子层,所以在同一周期,故C正确;
D、Si、P、S都有3个电子层,则在同一周期,故D正确;
故选DC.
点评:本题考查元素在周期表中的位置,明确原子的电子排布与元素在周期表中的位置关系是解答本题的 关键,难度不大.
关键,难度不大.
下表为元素周期表的一部分,请回答有关问题:

(1)⑤和⑧的元素符号是 和 ;
(2)表中最活泼的金属是 ,非金属最强的元素是 ;(填写元素符号)
(3)①和②可形成 化合物(填“离子”或“共价”);
(4)⑦和⑩单质氧化性 强(填写元素符号);
(5)⑥的最高正价是 .
知识点:元素周期律与元素周期表
(1)Si;Ar;
(2)K;F;
(3)共价;
(4)Cl;
(5)+6.
考点:元素周期律和元素周期表的综合应用.
分析:(1)由元素在周期表中位置,可知①为C、②为O、③为F、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br;
(2)同周期自左而右金属性减弱、非金属性正确,同主族自上而下金属性增强、非金属性减弱;
(3)①和②可形成的化合物为CO、二氧化碳;
(4)非金属性越强,单质氧化性越强;
(5)主族元素最高正化合价等于族序数(O、F元素除外).
解答:解:(1)由元素在周期表中位置,可知①为C、②为O、③为F、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,故答案为:Si;Ar;
(2)同周期自左而右金属性减弱、非金属性正确,同主族自上而下金属性增强、非金属性减弱,故K的金属性最强、F的非金属性最强,故答案为:K;F;
(3)①和②可形成的化合物为CO、二氧化碳,均属于共价化合物,故答案为:共价;
(4)非金属性越强,单质氧化性越强,同主族自上而下非金属性减弱,非金属性越强,故Cl元素单质氧化强,故答案为:Cl;
(5)⑥处于第三周期ⅥA族,最高正化合价为+6,故答案为:+6.
点评:本题考查元素周期表与元素周期律综合应用,比较基础,有利于基础知识的巩固.
按要求填空:
(1)Al原子结构示意图 ;该元素位于第 周期,第 族.
(2)写出N2的结构式 ,N2含有 键(填“极性”或“非极性”).
知识点:化学用语
(1) ;三;ⅢA;
;三;ⅢA;
(2)N≡N;非极性.
考点:原子结构示意图;结构式;极性键和非极性键.
分析:(1)原子结构示意图是表示原子核电荷数和电子层排布的图示形式,小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数,根据核外电子排布规律确 定各层电子数,画出原子结构示意图,对于主族元素,周期数=电子层数,族序数=最外层电子数,据此判断该元素在周期表中位置;
定各层电子数,画出原子结构示意图,对于主族元素,周期数=电子层数,族序数=最外层电子数,据此判断该元素在周期表中位置;
(2)N2 分子中,两个氮原子各拿出3个电子形成3对共用电子对;由同种元素的原子形成共价键为非极性键.
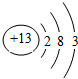
解答:解:(1)Al原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,原子结构示意图为 ,主族元素周期数=电子层数,族序数=最外层电子数,所以铝元素位于周期表中第三周期第ⅢA族,
,主族元素周期数=电子层数,族序数=最外层电子数,所以铝元素位于周期表中第三周期第ⅢA族,
故答案为: ;三;ⅢA;
;三;ⅢA;
(2)氮气分子中存在氮氮三键,氮气的结构式为:N≡N;单质氮是由氮原子与氮原子之间构成的共价键,属于非极性共价键,
故答案为:N≡N;非极性.
点评:本题考查原子结构与位置关系、原子结构示意图、分子的结构简式、分子的极性,题目难度较小,理解核外电子排布规律是关键.
用电子式表示下列物质的形成过程.
(1)H2O: .
(2)MgO: .
知识点:化学键
(1) ;
;
(2)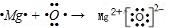 .
.
考点:用电子式表示简单的离子化合物和共价化合物的形成.
分析:(1)H2O为共价化合物,分子中中2个氢原子分别与氧原子共用一对电子形成2个H﹣O键;
(2)氧化镁为离子化合物,电子式中必须标出阴阳离子所带电荷.
解答:解:(1)H2O分子共价化合物,分子中存在两个氧氢键,用电子式表示其形成过程为
 ,
,
故答案为 ;
;
(2)氧化镁为离子化合物,氧化镁的电子式为 ,用电子式表示氧化镁的形成过程为
,用电子式表示氧化镁的形成过程为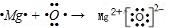 ,
,
故答案为: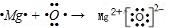 .
.
点评:本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式区别,试题培养了学生规范答题的能力.
A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子两倍,C燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素符号:A B C D
(2)写出C的单质在高温下与B的单质的反应方程式 ;
(3)把B、C、D的原子半径大小按顺序排列: ;
(4)B2D属于 化合物(填“离子”或“共价”).
知识点:元素周期律与元素周期表
(1)C;O;Na;S;
(2)2Na+O2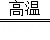 Na2O2;
Na2O2;
(3)Na>S>O;
(4)共价.
考点:位置结构性质的相互关系应用.
分析:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,所以A是C元素;C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,所以C是Na元素,B是O元素,D是S元素,由此分析解答.
解答:解:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,所以A是C元素;C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,所以C是Na元素,B是O元素,D是S元素.
(1)通过以上分析知,A是C,B是O,C是Na,D是S,故答案为:C;O;Na;S;
(2)钠在高温条件下和氧气反应生成过氧化钠,反应方程式为2Na+O2 Na2O2,故答案为:2Na+O2
Na2O2,故答案为:2Na+O2 Na2O2;
Na2O2;
(3)电子层数越多半径越大,电子层数相同时核电荷数越多半 径越小,所以原子半径大小顺序排列为:Na>S>O,故答案为:Na>S>O;
径越小,所以原子半径大小顺序排列为:Na>S>O,故答案为:Na>S>O;
(4)B2D是二氧化硫,是共价化合物,故答案为:共价.
点评:本题以元素的推断为载体考查了元素化合物的性质,难度不大,能正确推断元素是解本题的关键,明确微粒半径大小的比较方法.