用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.5.6 g铁粉在2.24 L(标准状态)氯气中充分燃烧,失去的电子数为0.3NA
B.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA
C.CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等
D.100℃时,1 L pH=6纯水中,含OH-数目为10-6NA
知识点:物质的量的计算
D
设NA为阿伏加德罗常数,下列叙述中正确的是
A.在含有4 mol Si—O键的石英晶体中,氧原子的数目为2NA
B.常温常压下,2.24 L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA
C.标准状况下,1 L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4
D.0.1 L 2 mol·L-1的(NH4)2S溶液中含有的S2-数目为0.2NA
知识点:物质的量的计算
A
根据下列化学实验事实得出的结论一定正确的是
A.向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解。
结论:该溶液中有SO
B.向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝。
结论:该溶液中有NH
C.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡,沉淀呈黄色。
结论:Ksp(AgCl)〈Ksp(AgI)
D.向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀。
结论:X中不含有醛基
知识点:物质的检验和鉴别
B
某溶液加入铝能产生氢气。则下列各组离子,在该水溶液中可以大量共存的是
A.Fe2+、K+、Cl-、NO B.K+、Mg2+、Cl-、SO
C.Na+、Fe3+、CO、SO D.NH、Ba2+、AlO、Cl-
知识点:离子反应
B
在溶液中加入足量Na2O2后仍能大量共存的离子组是
A.NH、Ba2+、Cl-、NO B.K+、AlO、Cl-、SO
C.Ca2+、Mg2+、NO、HCO3- D.Na+、Cl-、CO、SO
知识点:离子共存
B
在强酸溶液中,下列各组离子能够大量共存的是
A.Mg2+、Ca2+、HCO、Cl- B.Na+、AlO、Cl-、SO
C.K+、Fe2+、SO、Br- D.Fe2+、Ca2+、Cl-、NO
知识点:离子共存
C
下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是
A.FeBr2和Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
知识点:离子方程式
B
设阿伏加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体m g,含有b个分子,则ng该混合气体在相同状况下所占的体积(L)应是
A.
 B.
B. C.
C. D.
D.
知识点:物质的量的计算
A
固体A在一定温度下分解生成气体B、C、D:2A == B↑+ 2C↑+ 3D↑,若测得生成气体的质量是同体积氢气的15倍,则固体A的摩尔质量是
A.30 g·mol-1 B.60 g·mol-1 C.90 g·mol-1 D.120 g·mol-1
知识点:阿弗加德罗定律
B
密度为0.91g·cm-3的氨水,质量分数为0.25 ,该氨水用等体积的水稀释后,所得溶液的质量分数
,该氨水用等体积的水稀释后,所得溶液的质量分数
A.等于0.125 B.大于0.125 C.小于0.125 D.无法确定
知识点:溶液浓度的计算
C
在反应X + 2Y = R + 2M中,已知R和M的摩尔质量之比为22:9,当1.6g X与Y完全反应后,生成4.4 g R,则此反应中Y 和M的质量之比为
A.16:9 B.23:9 C.32:9 D.46:9
知识点:物质的量
A
Fe、CO、CuO、NaOH溶液、Na2CO3溶液、Ba(OH)2溶液、稀H2SO4七种物质,在常温下两种物质间能发生的化学反应有
A.4个 B.5个 C.6个 D.7个
知识点:元素及其化合物的综合运用
D
精确配制一定物质的量浓度的NaOH溶液,下面实验操作中,正确的是
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放人容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液转移到未经干燥的容量瓶中
知识点:仪器和基本操作
D
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强相等 B.O2比O3的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
知识点:阿弗加德罗定律
A
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4===2CuI↓+13I2+12K2SO4+12H2O其中1 mol氧化剂在反应中得到的电子为
A.10 mol B.11 mol C.12 mol D.13 mol
知识点:氧化还原反应
B
一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:
2AtI+2Zn===ZnI2+ZnAt2 AtI+2NH3(l)===NH4I+NH2At
则下列叙述正确的是
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D.AtI与液氨反应 ,是自身氧化还原反应
,是自身氧化还原反应
知识点:氧化还原反应
B
用高铁酸钠(Na2FeO4)对河 湖水消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是
湖水消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-转移
D.Na2FeO4能杀菌消毒是因其具有强氧化性
知识点:氧化还原反应
D
从矿物学资料查得一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法中正确的是
A.CuSO4是氧化剂,FeS2是还原剂 B.产物中的SO有一部分是氧化产物
C.Cu2S既是氧化产物又是还原产物 D.5 mol FeS2发生反应,有10 mol e-转移
知识点:氧化还原反应
B
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O+O2+xOH-===Fe3O4+S4O+2H2O,下列说法正确的是
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O都是还原剂
C.x=2 D.每生成1 mol Fe3O4,则转移电子数为3 mol
知识点:氧化还原反应
B
某温度下,将Cl2通入KOH溶液中得KCl、KClO3和KClO的混合溶液。经测定ClO3-和ClO-物质的量之比为2:1,则反应中被还原的Cl2与被氧化Cl2的的物质的量之比为
A.2:3 B.3:4 C.11:3 D.10:3
知识点:氧化还原反应
C
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g· mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为_______ 个。
(3)该气体在标准状况下的体积为_________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______ 。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ m ol·L-1
ol·L-1
知识点:物质的量的计算
(1)m/M (2)2mNA/M (3)22.4m/M(4)m/m+1000(5)m/MV
(1)用18 mol·L-1硫酸配制100 mL 1.0 mol·L-1硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平  C.玻璃棒 D.50 mL容量瓶
C.玻璃棒 D.50 mL容量瓶
E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
实验时应选用仪器的先后顺序是________(填入编号)。
(2)在容量瓶的使用方法中,下列操作不正确的是________(填写标号)。使结果一定偏大的是________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
知识点:仪器和基本操作
(1)GEFCH或EGFCH
(2)BCD B
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________。
(3)根据上述反应可推知_ __
__ _____。
_____。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
知识点:氧化还原反应
(1)AsH3
(2)Br2
(3)AC
已知氧化性BrO>ClO>Cl2>IO>I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是:
①_____________________________________________________________________;
②_____________________________________________________________________。
(2)写 出有关的离子方程式:
出有关的离子方程式:
①_____________________________________________________________________;
②____________________ _____________________________________。
_____________________________________。
知识点:氧化还原反应
(1) ①溶液由无色变蓝色 ②溶液蓝色褪去
(2) 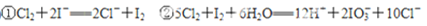
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO、SO、CO,现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是___________________________________________
_______________________________________________________________________;
(2)E溶液是________,判断依据是_________________________________________
______________________________ _______________________________;
_______________________________;
(3)写出下列四种化合物的化学式:A_________、C_________、D_________、F_________。
知识点:物质的检验和鉴别
(1)AgNO3+NH3·H2O=AgOH↓+NH4NO3
AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
(2) 碳酸钾
由①中碱性强弱的顺序可知E是碳酸盐,6种阳离子只有K+能和碳酸根形成可溶性盐
(3)Ba(OH)2 (CH3COO)2 Ca AlCl3 FeSO4