食品添加剂关系到大家健康,下列物质中的添加剂作用不正确的是( )

A.① B.② C.③ D.④
知识点:化学与生活
A
试题解析:加碘食盐,是为了补充人体内需要的微量元素碘,防止甲状腺肿大,不能防治高血压;其他三个选项的措施都是正确的。
下列与处理方法对应的反应方程式不正确的是( )
A.工业上用水吸收NO2生产硝酸: 3NO2 + H2O = 2HNO3 + NO
B.用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++ 3OH-= Fe(OH)3↓
C.用熟石灰处理泄漏的液氯:2Ca(OH)2 +2Cl2 = CaCl2 + Ca(ClO)2 +2H2O
D.用明矾除去水中的悬浮颗粒物:Al3++ 3H2O  Al(OH)3 (胶体) + 3H+
Al(OH)3 (胶体) + 3H+
知识点:离子方程式
B
试题解析:B中离子方程式中氨水不能拆开。
下列说法不正确的是( )
A.乙二醇用于汽车防冻液
B.麦芽糖在水解前后均能发生银镜反应
C.1-氯丙烷和2-氯丙烷发生消去反应的产物不同
D.H2N—CH2—COOH的缩聚产物中含 结构
结构
知识点:卤代烃
C
试题解析:1-氯丙烷和2-氯丙烷发生消去反应的产物都是丙烯,其他选项均正确。
依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物NH3、H2O、HF的稳定性
C.碱金属单质Li、Na、K与水反应的剧烈程度
D.1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少
知识点:元素周期律与元素周期表
D
试题解析:金属性和非金属性的强弱(可简单的理解为氧化还原性的强弱)是得失电子的趋势,与其得失电子的多少无关,D错误,ABC都可说明问题。
下图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液。有关说法不正确的是( )

A.a极为负极,电子由a极流向b极
B.a极的电极反应式是:H2 -2e-= 2H+
C.电池工作一段时间后,装置中c(H2SO4)增大
D.若将H2改为等物质的量CH4,O2的用量增多
知识点:原电池
C
试题解析:该氢氧燃料电池工作时生成了水,c(H2SO4)减小。
用氯气制取并获得碘单质,不能实现实验目的的装置是( )

A.用甲制取少量氯气
B.用乙氧化溶液中的碘离子
C.用丙提取置换出来的碘
D.用丁过滤I2的CCl4溶液得碘单质
知识点:物质的分离、除杂和提纯
D
试题解析:I2的CCl4溶液要分离得碘单质,应蒸馏,不能用过滤。
根据下列实验及现象,能量关系正确的是( )
实验及现象
能量关系
①
将“NO2”球置于热水中,红棕色增加
N2O4(g) 2NO2(g) △H<0
2NO2(g) △H<0
②
NaOH与HCl溶液混合,溶液温度升高

③
钠投入水中,熔化成小球

④
微热含酚酞的Na2CO3溶液,红色加深
CO32-(aq)+H2O(1)  HCO3-(aq)+OH-(aq) △H<0
HCO3-(aq)+OH-(aq) △H<0
A.① B.② C.③ D.④
知识点:化学反应与能量的变化
B
试题解析:A、D实验△H>0,C实验放热,生成物能量低,只有B实验的中和反应放热是正确的。
用于合成树脂的四溴双酚F、药物透过性材料高分子化合物PCL合成如下。


(1)W中—R是 。
(2)A的结构简式是_________。
(3)A生成B和CH3COOH的反应类型是_________。
(4)D→X过程中所引入的官能团分别是_________。
(5)E的分子式是C6H10O,E与H2反应可生成X。H的结构简式是________。
(6)有机物Y的苯环上只有2种不同化学环境的氢原子。
① 由B生成Y的反应方程式是__________。
② 由Y生成四溴双酚F的反应方程式是________。
③ 在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,其结构简式可能是 。
(7)高分子化合物PCL的结构简式是________。
知识点:有机化学知识综合应用
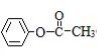
(1)甲基(或—CH3)
(2)
(3)取代反应(水解反应)
(4)氯原子(或—Cl)、羟基(—OH)
(5) 
(6)
①
② 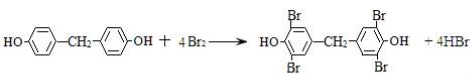
③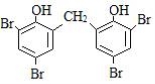 或
或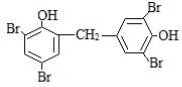
(7)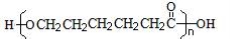
试题解析:因A酸性条件下水解得乙酸和苯酚B,所以W中—R是—CH3,则A的结构简式为: :环己烷D经两步反应分别引入了氯原子和羟基,得到环己醇X ,由新信息E应是 X氧化得到的环己酮,即H的结构简式为:
:环己烷D经两步反应分别引入了氯原子和羟基,得到环己醇X ,由新信息E应是 X氧化得到的环己酮,即H的结构简式为: ,H在酸性条件下水解然后再缩聚得高聚物PCL,即:
,H在酸性条件下水解然后再缩聚得高聚物PCL,即: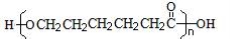
因Y的苯环上只有2种不同化学环境的氢原子,所以,由B生成Y的反应方程式是: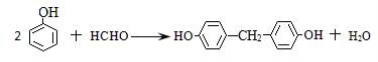
Y和溴水1:4取代的方程式为:
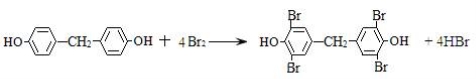
在该反应中还可能生成


某同学分析Zn与稀H2SO4的反应。
(1)该反应的离子方程式是 。
(2)制H2时,用稀硫酸而不用浓硫酸,原因是_________。
(3)已知:Zn(s)+1/2O2 (g)=ZnO(s) △H=-332 kJ/mol
ZnO(s) + H2SO4 (aq) = ZnSO4(aq) + H2O(l) △H=-112kJ/mol
H2(g) +1/2 O2(g) = H2O(l) △H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2时的反应热△H= kJ/mol。
(4)该同学用如下装置进行实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K)
34
59
86
117
…
102
1分钟水滴数(闭合K)
58
81
112
139
…
78
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率______(填“快”或“慢”),主要原因是_________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_________。
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是_______。
知识点:化学反应速率
(1)Zn +2H+= Zn2++ H2↑
(2)浓H2SO4具有强氧化性,不能生成氢气。
(3)-158
(4)①快,形成原电池反应速度快
②断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+)
③断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能。前者使溶液的温度升得更高,故反应速率更快。
试题解析:
(1)锌和稀硫酸反应离子方程式很简单:Zn +2H+= Zn2++ H2↑
(2)因浓H2SO4具有强氧化性,和锌反应时,放出的是SO2,不能生成氢气,故正确氢气不用浓硫酸而用稀硫酸。
(3)由盖斯定律,第一个方程式加第二个,再减去第三个得:Zn(s)+ H2SO4(aq)=ZnSO4(aq)+ H2(g)△H=-332-112+286=-158 kJ/mol
(4)①反应刚开始时,因闭合K时形成了原电池,故比断开K时,反应产生氢气的速率快;②到反应后期,先前断开K时,溶液中的c(H+)较大,随反应进行,溶液中c(H+)降低,故此时闭合K时反应速率较小;③ 在该阶段,断开K时,反应的化学能主要转化成热能;使溶液的温度升高,反应速率加快;而闭合K时,反应的化学能主要转化成电能,产生氢气速率就较慢。
某学生探究AgCl、Ag2S沉淀转化的原因。
步骤
现象
Ⅰ.将NaCl与AgNO3溶液混合
产生白色沉淀
Ⅱ.向所得固液混合物中加Na2S溶液
沉淀变为黑色
Ⅲ.滤出黑色沉淀,加入NaCl溶液
较长时间后,沉淀变为乳白色
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ. 向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ. 向Y滴加KI溶液,产生黄色沉淀
① 由ⅰ判断,滤液X中被检出的离子是 。
② 由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。

现象
B:一段时间后,出现乳白色沉淀
C:一段时间后,无明显变化
① A中产生的气体是_________。
② C中盛放的物质W是_________。
③ 该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S + + + 2H2O  4AgCl + + 4NaOH
4AgCl + + 4NaOH
④ B中NaCl的作用是_______。
知识点:综合性实验
(1)AgCl
(2)2AgCl(s) + S2- Ag2S(s) + 2Cl-,Ag2S比AgCl溶解度更小
Ag2S(s) + 2Cl-,Ag2S比AgCl溶解度更小
(3)① SO42- ② S
(4)① O2
② Ag2S 的悬浊液
③2Ag2S + 1 O2 + 4 NaCl + 2H2O  4AgCl + 2 S + 4NaOH
4AgCl + 2 S + 4NaOH
④ O2将Ag2S 氧化生成S时有Ag+游离出来,NaCl中大量的Cl-与游离的Ag+结合成AgCl沉淀。由于c(Ag+)减小,有利于③中反应平衡右移,B中最终出现乳白色沉淀。
试题解析:实验Ⅰ中的白色沉淀是当然是NaCl与AgNO3反应生成的AgCl,当加入Na2S溶液后,因Ag2S比AgCl溶解度更小,所以,就转化为更难溶的黑色Ag2S,即:2AgCl(s) + S2- Ag2S(s) + 2Cl-。
Ag2S(s) + 2Cl-。
在对步骤Ⅲ中乳白色沉淀进行的探究实验中,其中可能有原来被氧化的S单质,又被硝酸氧化,生成SO42-,遇Ba(NO3)2溶液产生白色沉淀BaSO4;剩余的白色沉淀是AgCl。
双氧水在MnO2的催化作用下分解,放出的气体肯定是氧气;作为对比实验,B中是含有NaCl溶液的Ag2S,C中必然是普通没有NaCl的Ag2S ;由质量守恒定律反应物缺1mol的O2和4mol的NaCl,产物中缺2mol的S,配平即可。
在该实验中,O2将Ag2S 氧化生成了S,使Ag+游离出来,而NaCl溶液中的Cl-与Ag+结合成难溶AgCl沉淀,由于c(Ag+)减小,导致③中反应平衡右移,B中最终生成AgCl和S的沉淀混合物而呈乳白色。
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:

(1) Cu2S中Cu元素的化合价是 价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的 极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是 。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。

①在阴极放电的物质是___________。
②在阳极生成SO3的电极反应式是____________。
(4)检测烟气中SO2脱除率的步骤如下:
i. 将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii. 加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii. 过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示i中溴水的主要作用____________。
② 若沉淀的质量越大,说明SO2的脱除率越____________(填“高”或“低”)。
知识点:铜及其化合物
(1)+1
(2)① 正
② Cu2+的氧化性大于Fe2+的氧化性
(3)① O2
② 2SO42――4e-= 2SO3↑ + O2↑
(4)
① SO32-+ Br2+ H2O = SO42- + 2Br-+ 2H+或SO32-+ Br2+2OH-= SO42-+ 2Br-+ H2O 等
②低
试题解析:在Cu2S中S呈-2价,Cu呈+1价;在粗铜精炼时粗铜被氧化,应接外电源的正极,此过程中Fe被氧化为Fe2+,其氧化性弱于Cu2+,故以离子形式留在电解质溶液里。在题给的烟气处理装置中,明显在阴极得电子的物质是氧气,氧化生成的SO42- 在阳极失去电子又得到氧气,即:2SO42--4e-= 2SO3↑+O2↑。在检验过程中,所加溴水用于氧化溶液中的SO32- ,离子方程式为:SO32- + Br2+ H2O = SO42- + 2Br-+ 2H+。此时,若沉淀的质量越大,说明残留的SO2愈多,即说明SO2的脱除率越低 。